VOYAGE VOYAGE
Le guselkumab est un nouvel anti-IL-23 qui vient d’avoir l’AMM et le remboursement en France (Tremfya®). Ce traitement a été évalué dans des essais de phase 3 versus adalimumab : VOYAGE 1 et VOYAGE 2. La particularité de l’étude VOYAGE 2 était une phase d’arrêt du traitement montrant les propriétés de maintien d’efficacité dans le temps et de rémanence de ce traitement.
Deux posters sont présentés à propos de la phase d’extension de ces deux études.
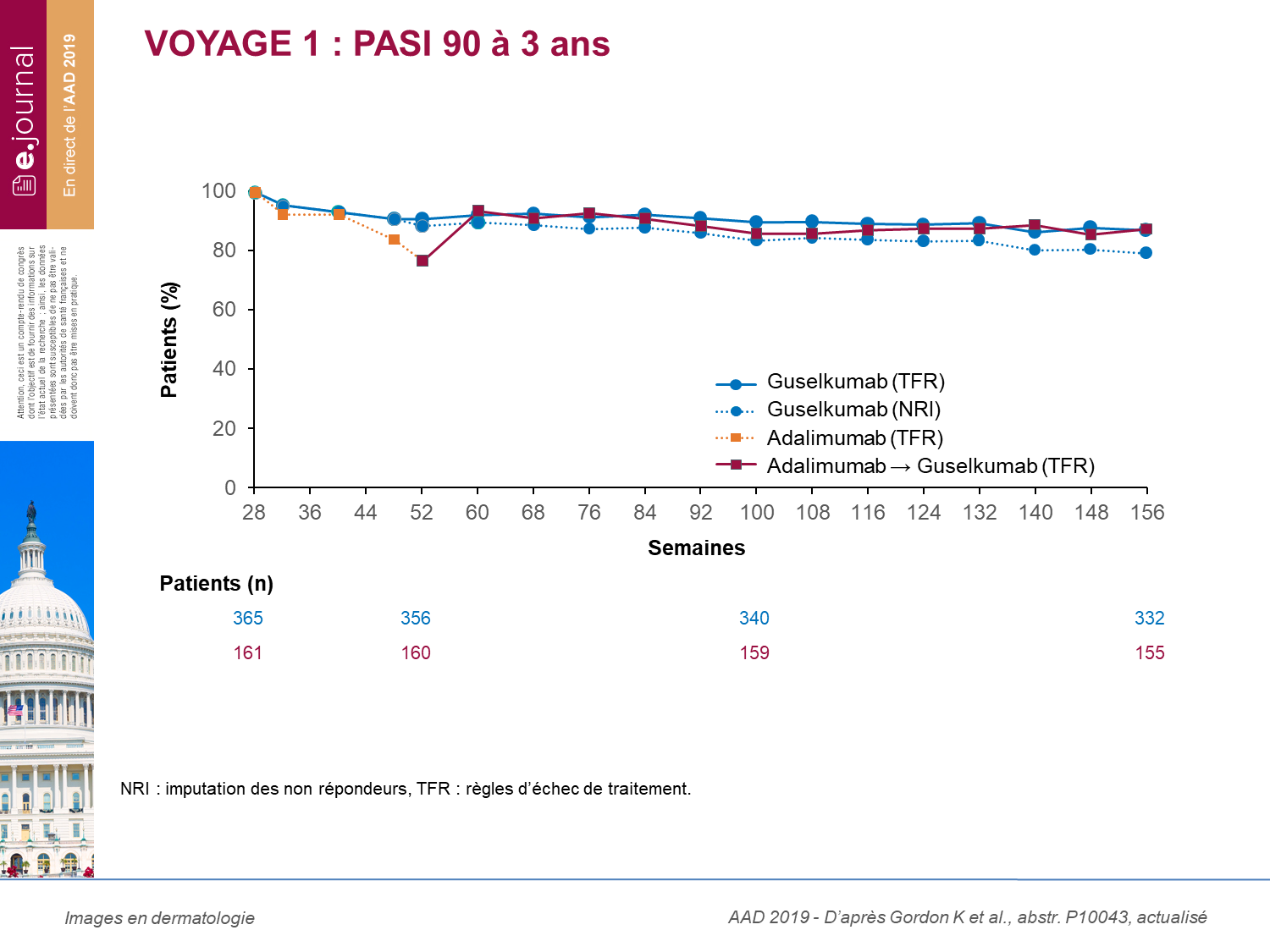
Pour l’étude VOYAGE 1, l’objectif était de savoir quel pourcentage de patients, parmi ceux ayant obtenu une réponse PASI 90 à la semaine 28, maintenait cette réponse PASI 90 à 3 ans.
Tous les patients recevaient du guselkumab 100 mg toutes les 8 semaines à partir de la semaine 52 jusqu’à la semaine 156.
Parmi les 365 répondeurs PASI 90 à S28, 56,9 % ont une réponse PASI 100 à 3 ans, et 87,3 % une réponse PASI 9O. Parmi les patients traités la première année par adalimumab (n = 161), 76,9 % avaient une réponse PASI 90 à la semaine 52 et 87,7 % avaient une réponse PASI 90 à 3 ans (après 2 ans de traitement par guselkumab).
Pour l’étude VOYAGE 2, tous les patients recevaient le traitement par guselkumab 100 mg/8 semaines à partir de la semaine 76.
Au total, 72,2 % des patients avaient un PASI 90 à la semaine 156.
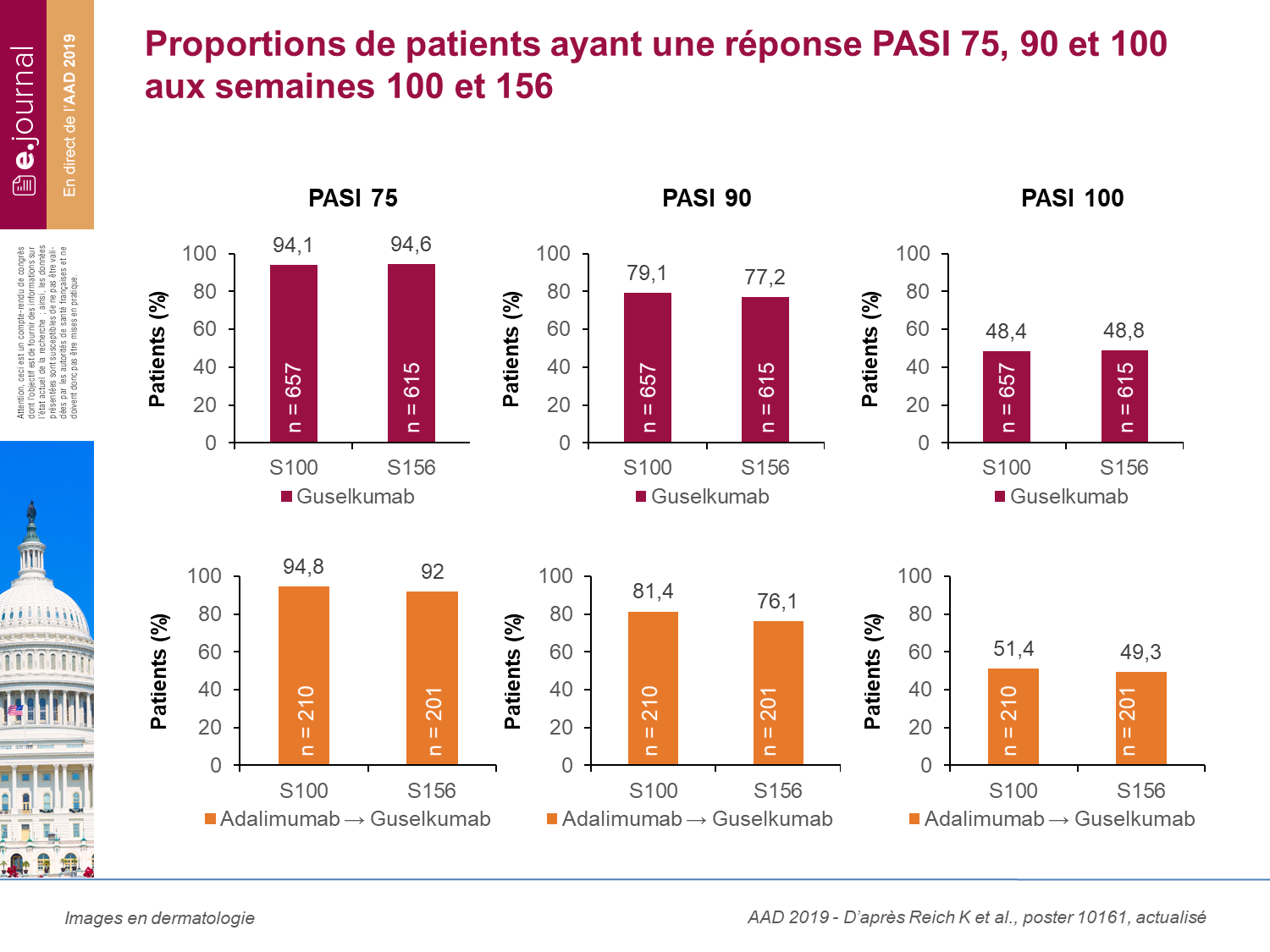
Les sorties d’étude n’étaient pas liées à un manque d’efficacité.
Concernant la tolérance, sur les 727 patients ayant achevé les 3 ans de suivi, sont rapportés 2,5 % d’infections sévères et 1 % (n = 7) d’évènements cardiovasculaires majeurs (non précisés).
Le guselkumab est un traitement qui parait donc avoir un bon taux de maintien de la réponse dans le temps.








