Recommandations ESMO pour l’utilisation du séquençage haut débit dans les cancers avancés : à proposer en centre de référence pour les cancers du sein
Les techniques de séquençages haut débit (ou screening NGS) ont depuis plusieurs années gagné l’ensemble des laboratoires de biologie moléculaire des centres de référence d’oncologie. En plus de l’utilisation de routine pour des séquençages ciblées dans les indications faisant l’objet d’un remboursement (visée théranostique dans les cancers bronchiques ou coliques par exemple), l’utilisation de ces technologies à visée de recherche de cibles thérapeutiques présente un essor hétérogène reposant sur des équipes académiques spécialisées. Ces équipes académiques sont organisées autour de services dits de phases précoces avec des RCP moléculaires qui analysent et orientent les prises en charge découlant de ces screening NGS.
L’objectif de ces analyses NGS est de rechercher des cibles dites drivers actionnables au sein de chaque tumeur afin de personnaliser au mieux les traitements de chaque patient. Les différentes données publiées dans le domaine du cancer du sein avancé sont relativement décevantes. Notons que l’essai SAFIR01 ne retrouvait que 9 % de réponse objective pour une approche de traitement adapté à une anomalie moléculaire (1). Ces premières données sont donc bien loin des succès des anti-HER2 en cas de tumeurs ERBB2 amplifiées par exemple. Ces premières données limitées ont rapidement soulevé la problématique de la hiérarchisation des anomalies moléculaires rencontrées dans les cancers du sein et leurs intérêts théranostiques.
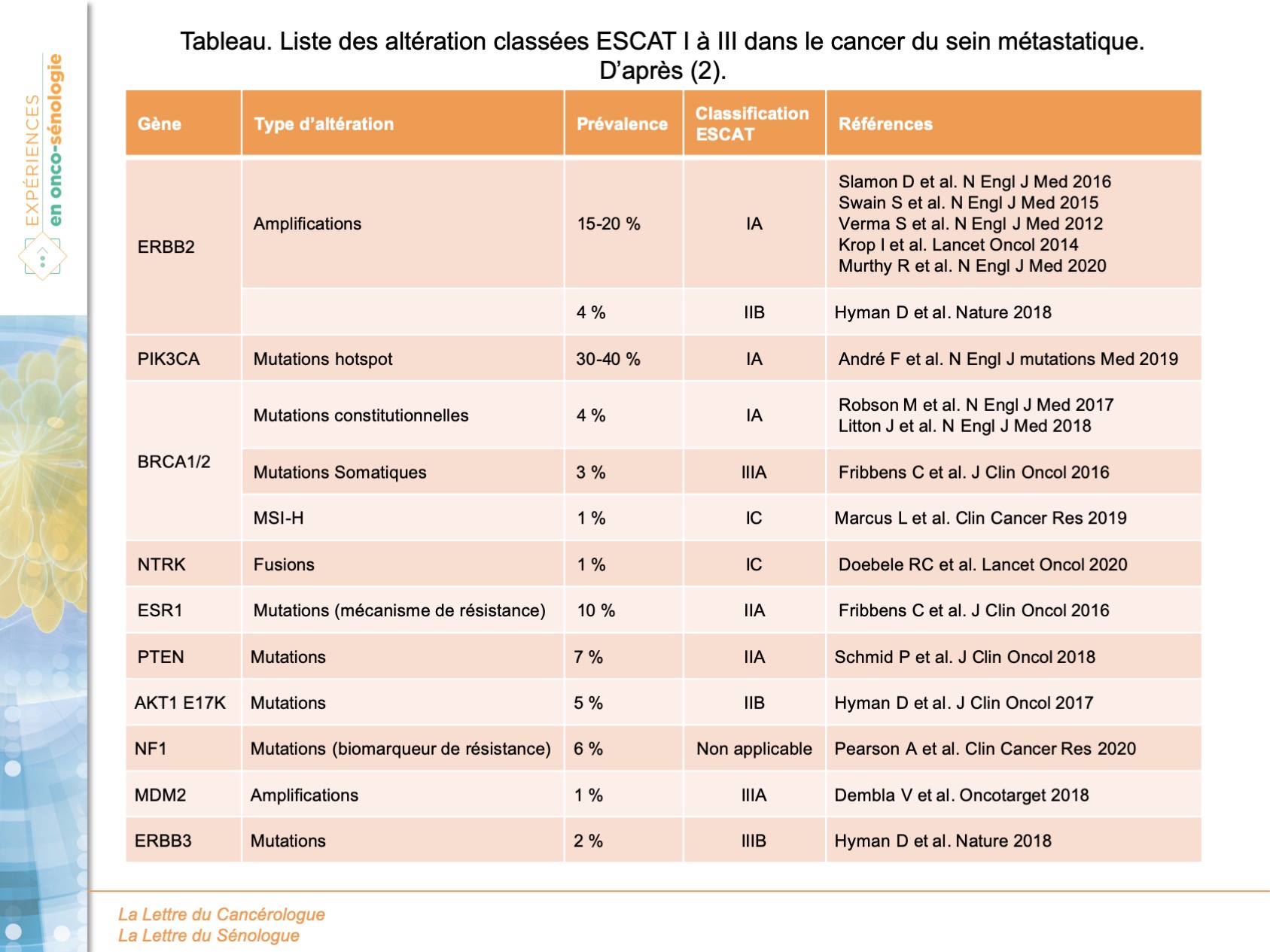
L’ESMO a ainsi proposé une classification dite ESCAT (ESMO Scale for Clinical Actionability of molecular Targets (ESCAT)). La classification ESCAT permet d’attribuer un rang d’intérêt à la corrélation entre une molécule et une/des altération(s) génétique(s) selon leurs actionnabilités. ESCAT I correspond à une corrélation altération/molécule validée par un/des essai(s) thérapeutique(s), ECSAT II correspond à une corrélation retrouvée dans une phase 1/2 ou sur analyse rétrospectives d’essai randomisé ; ESCAT III correspond à une corrélation validée dans un autre type de cancer que celui d’intérêt et ESCTA IV correspond à des données de corrélation issues de travaux uniquement précliniques.
L’objectif de ces recommandations ESMO publiées par un panel international (2) est de définir l’utilité clinique des techniques de séquençage haut débit/screening NGS ainsi que la manière de les utiliser. La question principale posée aux experts est celle de l’intérêt de l’utilisation de larges panels de gènes à visée de screening chez des patients avec cancer avancé versus des techniques de PCR ou d’immunohistochimie. Les auteurs sont partis des mutations récurrentes les plus fréquentes dans les 8 cancers responsables du plus grand nombre de décès, dont le cancer du sein. De manière spécifique au cancer du sein, les altérations génétiques d’intérêts retenues (décrites dans le tableau) sont les amplifications et mutations d’ERBB2 (traitements anti-HER2 disponibles ; nératinib pour les mutations), les mutations de PIK3CA (alpélisib), les inhibiteurs de PARP pour les mutations BRCA. De manières plus rares, les instabilités microsatellitaires et les fusions de NTRK font également l’objet de traitements spécifiques efficaces.
Les recommandations proposent 3 niveaux de réponses différentes : un premier niveau correspondant à une recommandation pour la pratique quotidienne courante, un deuxième niveau correspondant à la pratique spécifique des centres de soin et de recherche clinique académiques et enfin un niveau d’intérêt individuel à l’échelle de chaque patient.
Les experts, en premier niveau de recommandation et devant les données disponibles actuellement, ne retiennent pas l’indication de proposer un séquençage large NGS en pratique quotidienne pour l’ensemble des patientes atteintes de cancer du sein avancé. Les auteurs justifient cette recommandation en se basant sur la liste des altérations retenues par la classification ESCAT décrites dans le tableau. Concernant BRCA, les études validant les inhibiteurs de PARP se basent sur le statut constitutionnel et non somatique, concernant le statut PIK3CA, celui-ci peut être déterminé par PCR et enfin le statut d’HER2 est défini par immunohistochimie. Ainsi, les auteurs ne retiennent pas d’intérêt en pratique courante du screening systématique par NGS.
Si l’on considère maintenant le deuxième niveau de perspective, celui d’un patient pris en charge en centre académique de référence, il existe un intérêt à réaliser un screening NGS en vue spécifique d’une inclusion dans des essais thérapeutiques testant l’hypothèse d’une corrélation entre statut mutationnel et molécule ciblées comme pour des mutations d’AKT1, de PTEN, d’ERBB2, ou l’apparition de mutations de résistance d’ESR1 ou de NF1.
Enfin, troisième niveau de perspective, les auteurs spécifient qu’un screening NGS peut être prescrit à titre individuel si le coût ne repose pas sur le système de santé et si la patiente est avertie du faible rendement de ces recherches. Ceci reposant sur une discussion partagée entre l’oncologue et sa patiente.
Ce que cet article apporte à ma pratique :
- Ces recommandations internationales ont le mérite de tenter d’unifier des pratiques hétérogènes vis-à-vis de la réalisation de screening NGS en situation de maladie avancée notamment dans le cancer du sein. Ces techniques ont un coût important qui doit être corrélé à leurs rendements thérapeutiques. Le choix des auteurs de sélectionner des couples altérations moléculaires/thérapies ciblées selon la classification ESCAT permet de retenir uniquement des indications claires de traitements avec un bénéfice prouvées pour nos patientes. Ces cibles sont peu nombreuses dans le cancer du sein (en nombre et en fréquence).
- Le message principal de ces recommandations est de limiter les prescriptions de screening NGS pour les patientes atteintes de cancer du sein avancé, uniquement dans le cadre de programme dédié dans des centres académiques ou en collaboration avec des centres académiques référents. Il n’y a donc pas de place à la recherche d’une altération éventuelle pouvant permettre l’attribution d’un traitement ciblé hors programme de recherche.
- L’objectif de ces screening NGS doit être d’inclure des patientes dans des essais thérapeutiques dédiés en fonction des anomalies génomiques retrouvées, ce qui permet de valider les cibles et les traitements selon la classification ESCAT.
À retenir
Le screening par NGS dans le cancer du sein avancé doit être effectué uniquement dans le cadre de programme de recherche en centre de référence. Il n’y a donc pas de place pour une recherche s’apparentant à une “pêche” à l’altération génomique qui pourrait éventuellement permettre l’attribution en hors AMM et hors essai d’une thérapie ciblée adaptée. Seule une visée d’inclusion dans un essai thérapeutique dédié permettra d’obtenir un bénéfice personnel potentiel pour nos patientes mais également un bénéfice commun en termes de générations de données scientifiques qui enrichiront de futures recommandations basées sur la classification ESCAT.
Références
1 André F, Bachelot B, Commo F, et al. Comparative genomic hybridisation array and DNA sequencing to direct treatment of metastatic breast cancer: a multicentre, prospective trial (SAFIR01/UNICANCER). Lancet Oncol 2014;15:267-74.
2 Mosele F et al. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol 2020 Aug 24;S0923-7534(20)39971-3.
















