TIL/PD-1 : et si les marqueurs immmunologiques étaient la clef du traitement néoadjuvant du cancer du sein triple-négatif précoce ?
Pour le cancer du sein triple-négatif précoce (eTNBC), l’étude randomisée de phase II GeparNuevo [1], étudiant l’ajout de durvalumab à une chimiothérapie à base d’anthracycline/taxanes, a montré une augmentation du taux de réponse complète histologique (pCR) uniquement dans le sous-groupe de patients prétraités par durvalumab seul avant le début de la chimiothérapie néoadjuvante. Le taux de pCR était de 53,4 % avec le durvalumab contre 44,2 % avec le placebo (OR = 1,45 ; IC : 0,80-2,63 ; NS) dans la population générale d’étude mais de 61,0 contre 41,4 %, (OR = 2,22 ; IC : 1,06-4,64 ; p = 0,035) respectivement pour le sous-groupe prétraité par durvalumab en monothérapie.
L’étude ancillaire de GeparNuevo publiée récemment par Karn et al. [1] visait à analyser la valeur prédictive de la charge mutationnelle tumorale (TMB), seule ou en combinaison avec un profil d’expression génique immunitaire (GEP) pour prédire la pCR. Karn et al. ont analysé à la fois les données de whole exome sequencing (WES) et de RNA-Seq sur 149 échantillons de eTNBC avant traitement néoadjuvant.
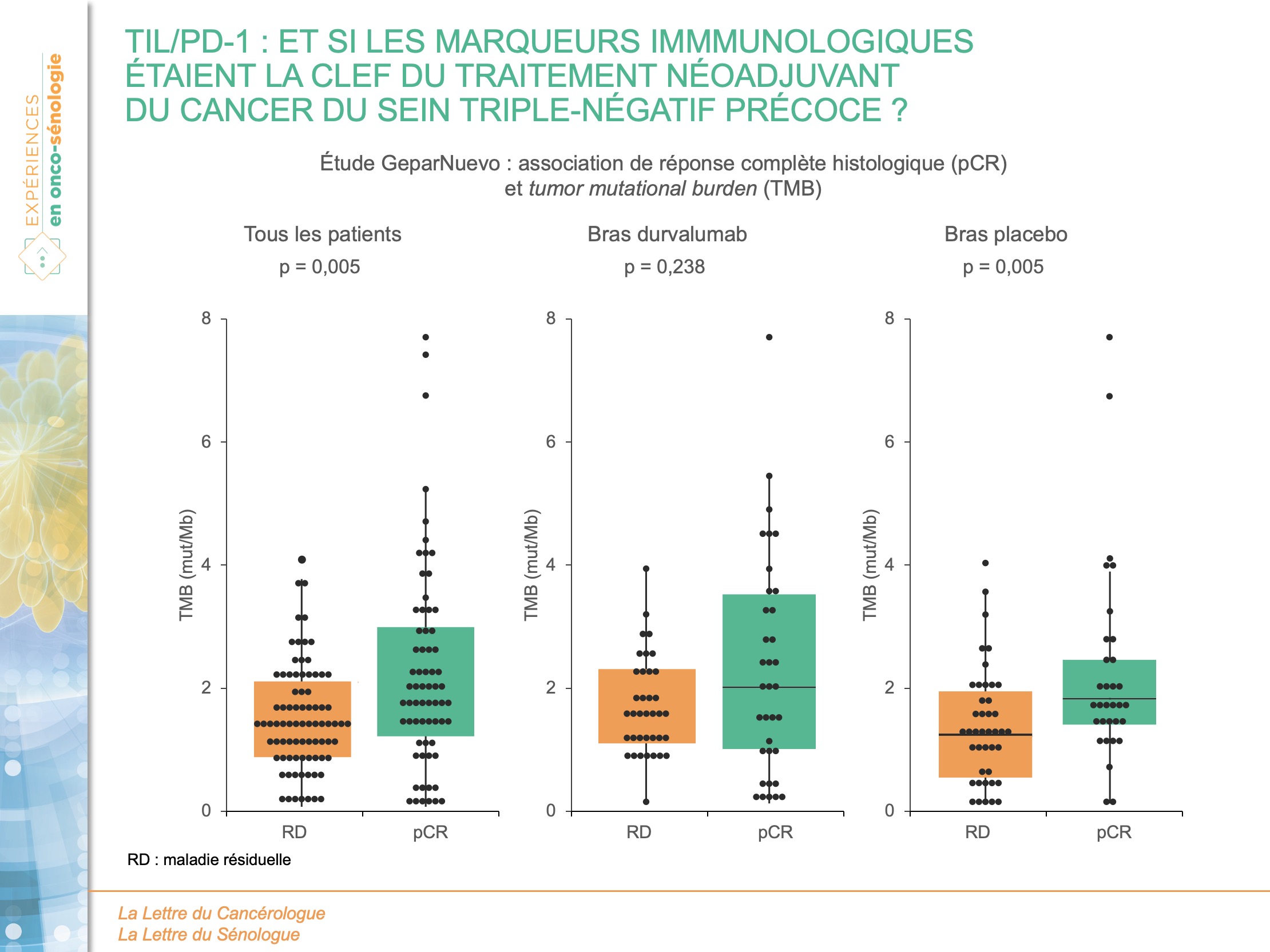
La TMB médiane de 1,52 mut/Mb (0,02-7,65) était significativement plus élevée chez les patients avec pCR (1,87 vs 1,39 ; p = 0,005). Dans l’analyse multivariée, le taux de réponse objective de la pCR par mut/Mb était de 2,06 (IC95 : 1,33-3,20 ; p = 0,001) chez tous les patients mais de 1,77 (IC95 : 1,00-3,13 ; p = 0,049) et 2,82 (IC95 : 1,21-6,54 ; p = 0,016) dans les groupes de traitement par durvalumab et placebo respectivement. La TMB comme variable continue et la GEP immunitaire (ou les lymphocytes infiltrant la tumeur TIL) prédisaient indépendamment la pCR (figure 1).
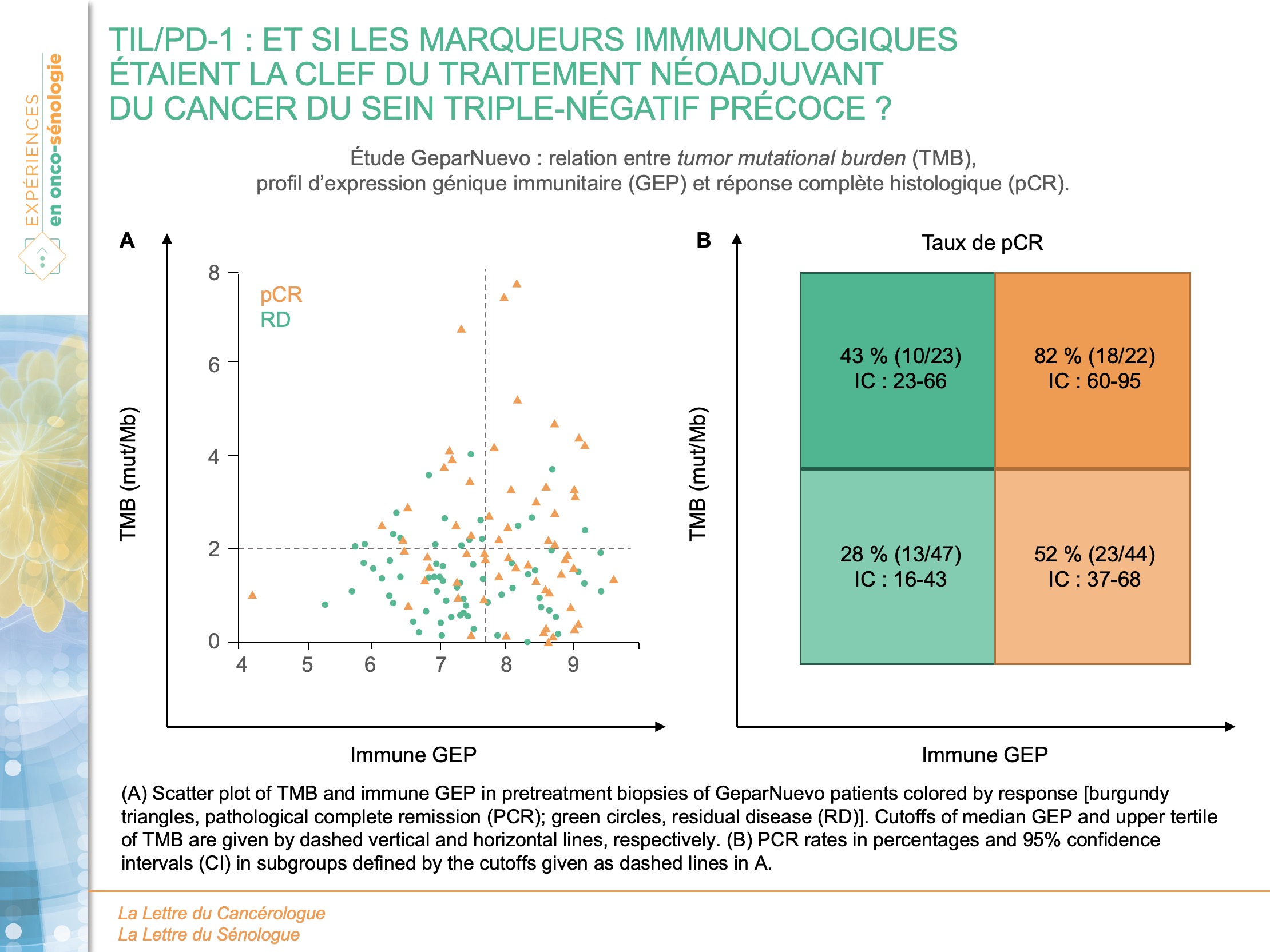
En stratifiant les patients dans des groupes basés sur le tertile supérieur de la TMB et la GEP médiane, un taux de pCR de 82 % (IC95 : 60-95) était observé dans le groupe TMB et GEP élevées, contre seulement 28 % (IC95 : 16-43) dans le groupe TMB et GEP faibles. Par conséquent, la TMB et la GEP immunitaire seraient des facteurs prédictifs indépendants de la pCR (figure 2).
Pour finir, des valeurs de TMB plus élevées étaient retrouvées dans les tumeurs présentant des mutations BRCA2, TP53, et ARID1A (p = 0,004, p = 0,011 et p = 0,040, respectivement) et une tendance pour les BRCA1, NOTCH1 et PTEN (p = 0,091, p = 0,063 et p = 0,099, respectivement) ; pas de différence retrouvée pour ATM, CCNE1, MYC et PIK3CA.
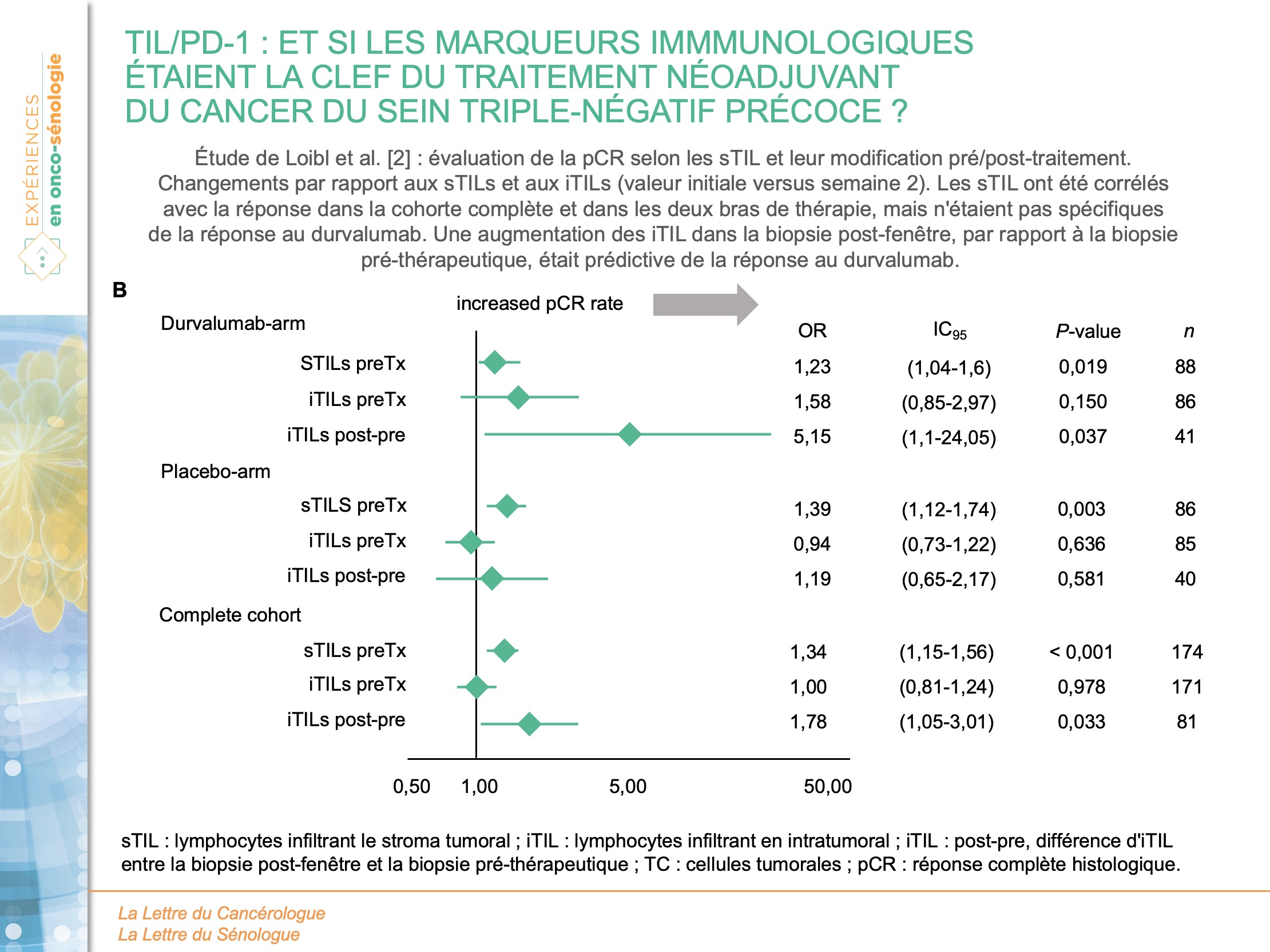
Qu’en est-il des TIL et du statut PD-L1 pour les eTNBC ? L’étude princeps de Loibl S et al. [2] avait posé comme principales hypothèses que la réponse accrue au durvalumab était associée à (i) une augmentation des sTILs, (ii) une augmentation des iTILs, (iii) une altération de la dynamique des iTILs dans les biopsies appariées avant et après le traitement par durvalumab en monothérapie (iTILs post-pré), (iv) une augmentation de l’expression pré-thérapeutique de PD-L1 (dans PD-L1-TC, PD-L1-IC ou combinés). Les iTIL en baseline ne permettaient pas de prédire la pCR. Toutefois, dans les 2 bras, une augmentation significative de la pCR (p < 0,01) était observée pour des sTIL plus élevés. Pendant la phase de traitement par durvalumab en monothérapie, les iTIL ont augmenté dans les 2 groupes. Ces changements des iTIL permettait de prédire de manière significative l’obtention d’une pCR en analyse univariée (OR = 5,15 ; IC95 : 1,10-24,05 ; p = 0,037) et en analyse de régression multivariée (OR = 9,36 ; IC95 : 1,26-69,65 ; p ) dans le groupe durvalumab. Néanmoins, dans le groupe placebo, le changement des iTIL n’avait aucune valeur prédictive (figure 3).
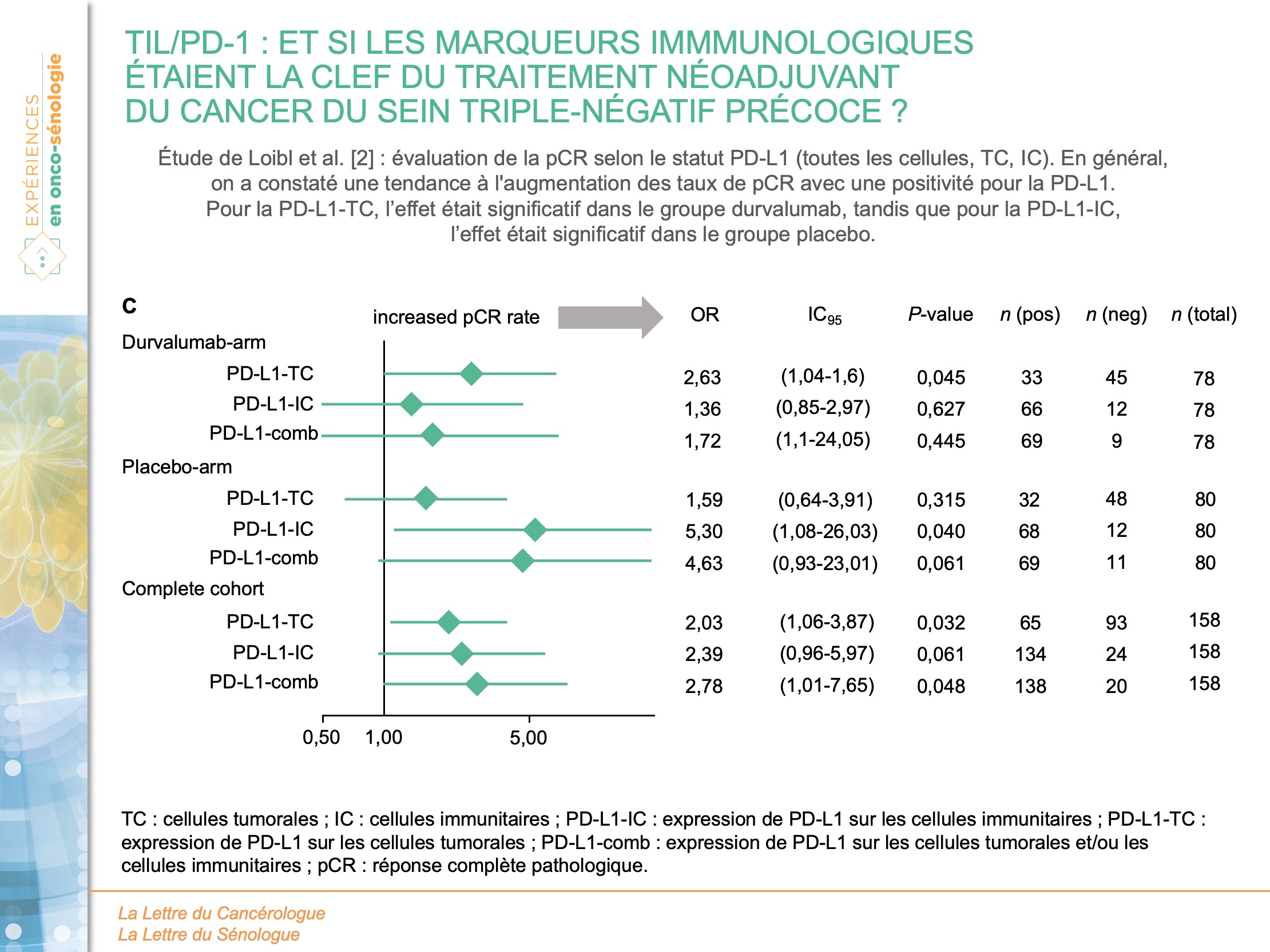
Concernant PD-L1, 138 des 158 échantillons disponibles étaient positifs au test PD-L1 avant traitement. Dans l’ensemble, le taux de pCR était de 54,3 % dans le groupe PD-L1-positif et de 30,0 % dans le groupe PD-L1-négatif (p = 0,048). Dans le groupe durvalumab, le taux de pCR était de 58,0 % pour les tumeurs PD-L1-positives contre 44,4 % pour les tumeurs PD-L1-négatives (p = 0,445) et dans le groupe placebo 50,7 % contre 18,2 %, respectivement (p = 0,061). Une tendance à une augmentation de la réponse dans la plupart des groupes PD-L1-positifs était observée, avec des résultats significatifs pour le PD-L1-TC dans le groupe durvalumab et pour le PD-L1-IC dans le groupe placebo (figure 4).
Ces résultats ne sont pas sans rappeler ceux de l’essai NeoTRIPaPDL1 (NCT02620280) présentés à l’ESM0 2020 par Giampaolo Bianchini et al., étude ancillaire de NeoTRIP évaluant l’effet des TIL et de l’expression du PD-L1 dans l’obtention de la pCR. La pCR était augmentée de plus de 10 % dans le groupe des immune-enrichis avec 87,0 % vs 72,0 % [Δ15 %] (IC2/3), 56,2 % vs 44,0 % [Δ12,2 %] (IC1) et 35,1 % vs 41,1 % [Δ-6,0 %] (IC0). Par contre, l’adjonction d’atézolizumab ne permettait pas une augmentation statistiquement significative de la pCR (52,3 % versus 47,7 %, delta 4,62 %, p = 0,46) dans la population générale de l’étude. A contrario, l’étude IMpassion-031 également présentée à l’ESMO 2020, a montré des résultats intéressants avec une amélioration de la pCR quel que soit le statut PD-L1 rappelant les premiers résultats positifs de l’étude KEYNOTE 522.
Comment expliquer ces différences ? Comme dans GueparNuevo, dans NeoTRIPaPDL1, l’immunothérapie avait permis l’enrichissement des tumeurs en TIL et en PD-L1 IC+. Des tumeurs immuno-négatives étaient devenues immuno-positives sous l’effet d’une immunothérapie. Le score PD-L1 IC+ augmentait de 45,4 à 74,7 % avec l’adjonction d’atézolizumab (p = 0,03) (65,8 % de changement en positif), mais diminuait de 52,7 à 37,9 % en cas de chimiothérapie seule (p = 0,0001) (44,0 % de changement en négatif).
L’immunoconversion pourrait être l’un des maillons manquants pour comprendre l’immunothérapie dans le cancer du sein. Le tout est maintenant de trouver le bon partenaire de chimiothérapie à l’immunothérapie pour permettre cette immunoconversion pour la plus grande partie de la population… D’autres études restent nécessaires afin de pouvoir adapter, à terme, individuellement les thérapies dans le cancer du sein mais une chose est sûre : l’immunothérapie dans le cancer du sein n’a pas fini de nous surprendre !
Références
1. Karn T et al. Tumor mutational burden and immune infiltration as independent predictors of response to neoadjuvant immune checkpoint inhibition in early TNBC in GeparNuevo. Ann Oncol 2020;31:1216-22.
2. Loibl S et al. A randomised phase II study investigating durvalumab in addition to an anthracycline taxane-based neoadjuvant therapy in early triple-negative breast cancer: clinical results and biomarker analysis of GeparNuevo study. Ann Oncol 2019;30:1279-88.
















