Entrectinib chez les patients porteurs d’un CBNPC ROS1 ou d’une tumeur avancée ou métastatique NTRK : analyse intégrative des 3 essais de phase 1-2
Les réarrangements de ROS1 représentent 1 à 2 % des cancers bronchiques non à petites cellules (CBNPC). Chez les patients non éligibles à un traitement local, le crizotinib est recommandé en 1ère ligne de traitement avec des taux de réponses de 70 % et une médiane de survie sans progression (SSP) de 20,0 mois (1). Les réarrangements de NTRK regroupant les réarrangements de NTRK1, 2 et 3 (protéines de fusions TRKA, B et C), représentent 0,3 % des cancers toutes tumeurs solides confondues et moins d’1 % des CBNPC (2).
L’entrectinib est un inhibiteur multikinase efficace sur ROS1, TRK A, B et C et sur ALK, avec, in vitro, une efficacité 40 fois supérieure au crizotinib sur les réarrangements de ROS1, et une meilleure capacité à traverser la barrière hématoencéphalique. Ceci étant d’autant plus important que la proportion d’atteinte secondaire cérébrale au diagnostic chez les patients ROS1 est de l’ordre de 36 % (3), et que le crizotinib ne diffuse pas de façon optimale à travers la barrière hématoencéphalique.
Ces 2 articles (4, 5) sont des analyses similaires des patients traités par entrectinib dans 3 essais de phase I et II : 2 essais de phase I (ALKA-372-001 et STARTRK-1) et un essai de phase II (STARTRK-2) évaluant l’entrectinib chez des patients porteurs de tumeurs solides localement avancées ou métastatiques avec fusions de ROS1 et de NTRK.
Dans la première analyse (4), les patients étaient porteurs d’un CBNPC avancés ou métastatiques ROS1+ et dans la seconde (5) d’une tumeur solide avancée ou métastatique NTRK+. Le statut mutationnel était évalué selon un testing local en FISH, qPCR, NGS ADN ou RNA seq ou centralisé par RNAseq. Les patients inclus étaient naïfs d’inhibiteur de tyrosine kinase anti-ROS1 (ROS1i) ou anti-NTRK (NTRKi), PS 0-2, traités par entrectinib à la dose minimum de 600 mg par jour. Les métastases cérébrales asymptomatiques ou préalablement traitées étaient autorisées et les imageries cérébrales (scanner ou IRM) n’étaient systématiquement réalisées que si les patients avaient des métastases cérébrales au moment de l’inclusion.
Le critère de jugement principal commun était un critère composite associant le taux de réponse objective (réponse complète et réponse partielle selon RECIST1.1) et la durée de réponse (de la 1re réponse objective à la progression) selon un comité de revue indépendant. Les critères de jugement secondaires étaient la SSP, la SG, le bénéfice clinique (défini comme un contrôle de la maladie : réponse complète, partielle ou maladie stable pendant au moins 6 mois) et la tolérance. Chez les patients avec métastases cérébrales au moment de l’inclusion étaient également évalués le taux de réponse cérébrale, la durée de réponse intracrânienne et la SSP cérébrale.
Dans l’article d’A. Drilon et al. (4), évaluant l’entrectinib chez les patients porteurs d’un CBNPC ROS1, 53 patients ont été inclus dans l’analyse pour l’étude d’efficacité. L’âge médian était de 53 ans, 64 % étaient des femmes, 59 % étaient non-fumeurs, 51 % et 11 % étaient PS1 et 2 respectivement. Les patients étaient prétraités pour 2/3 d’entre eux (43 % en 2e ligne, 25 % en 3e ligne ou au-delà). La proportion de métastases cérébrales était de 43 % à l’inclusion et la durée de suivi moyenne était de 15,5 mois.
Ainsi, le taux de réponse objective était de 77 % (3 réponses complètes et 38 réponses partielles). Il était de 55 % au niveau cérébral et de 71 % pour les patients non prétraités par radiothérapie ou traités mais plus de 2 mois auparavant (figure 1 A et B).
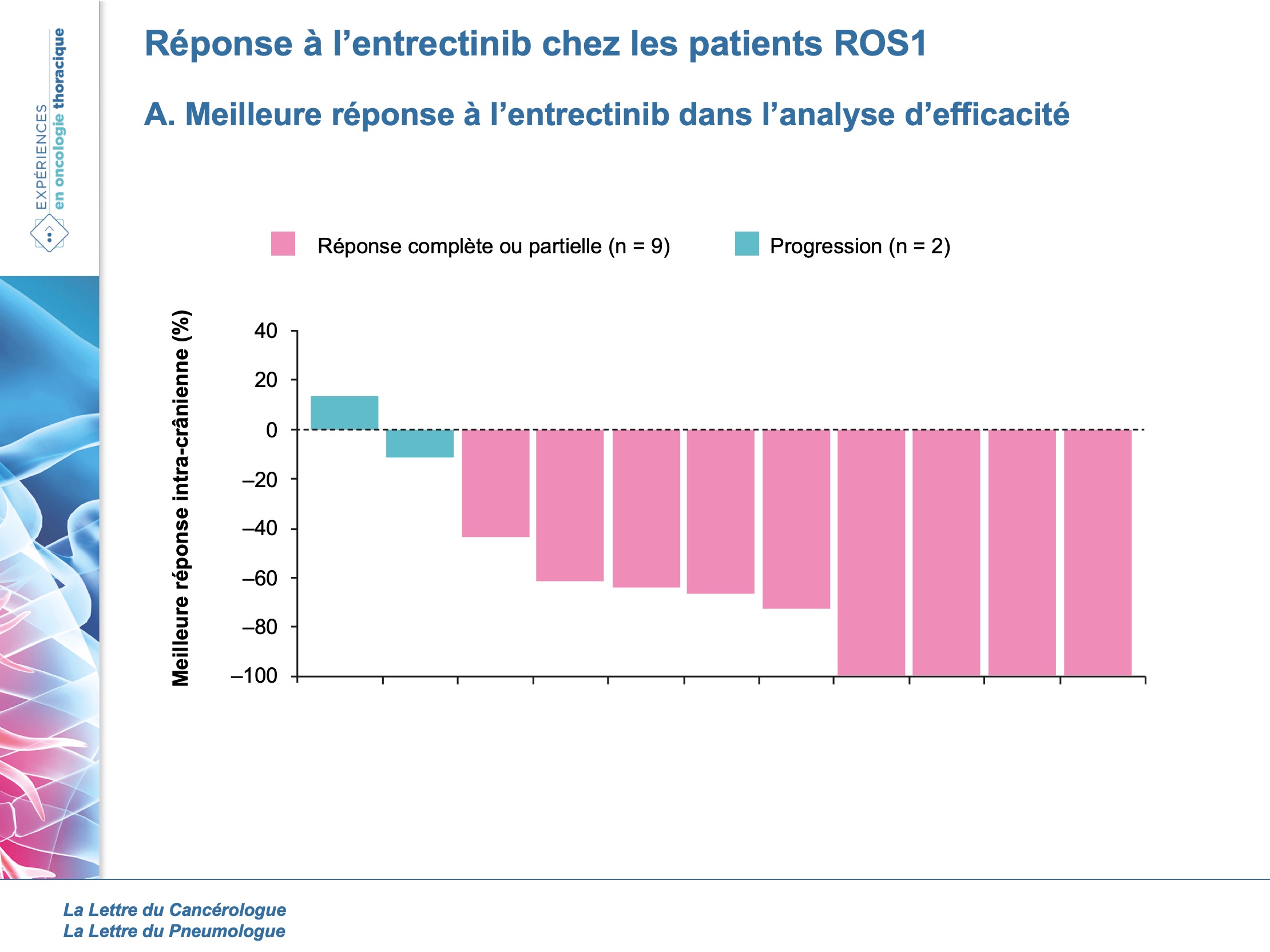
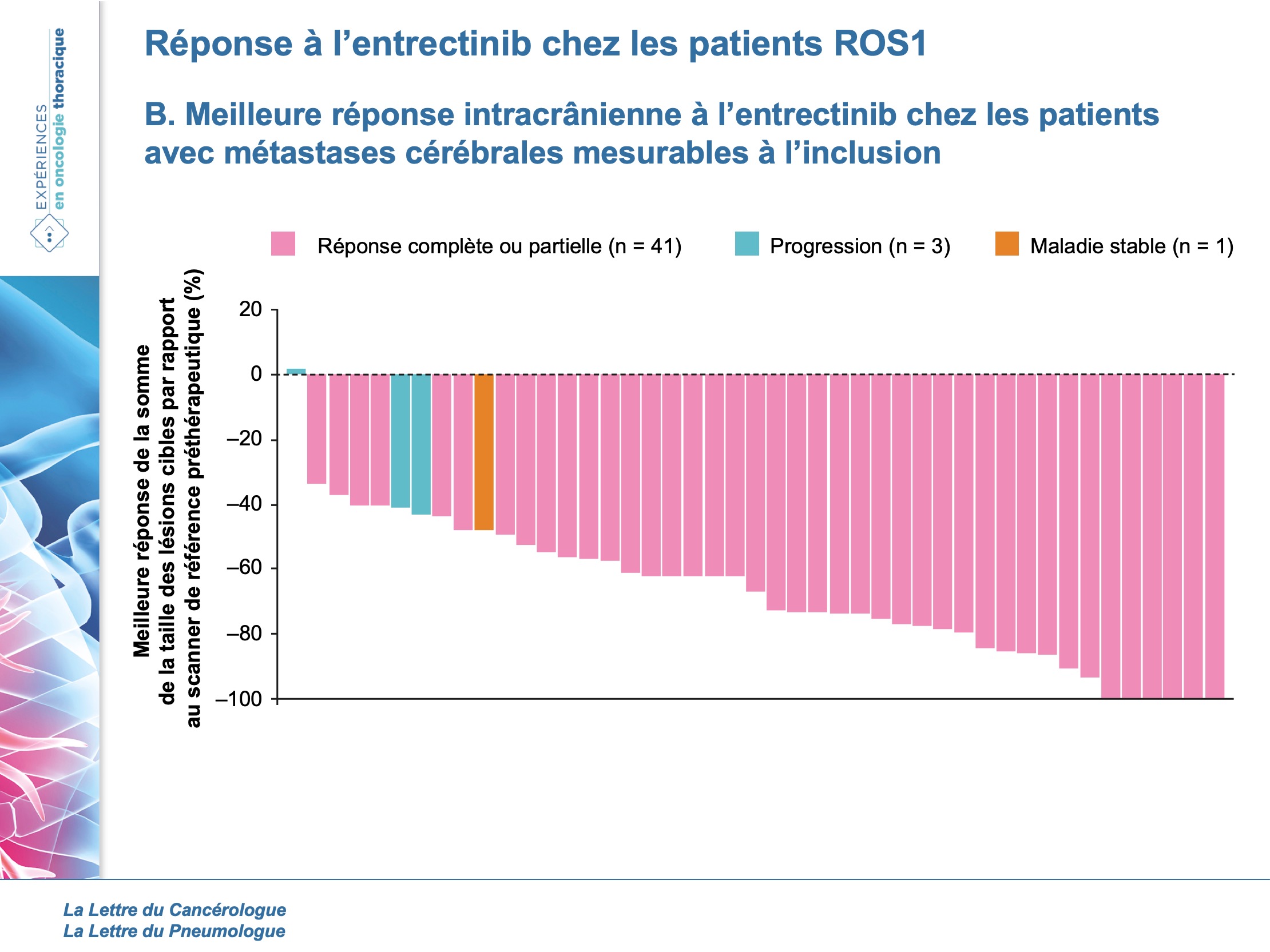
La durée médiane de réponse était de 24,6 mois et la médiane de SSP de 19 mois (13,6 mois chez les patients avec métastases cérébrales et 26,3 mois dans le groupe sans métastases cérébrales). Les données de SG n’étaient pas matures.
Les réponses étaient précoces, obtenues majoritairement dès la 1re évaluation radiologique. Aucune différence n’était retrouvée en fonction du partenaire de fusion.
L’article de R. Doebele et al. (5) évaluait l’entrectinib chez les patients porteurs d’une tumeur NTRK. Nous réaliserons un focus particulier sur les patients porteurs d’un CBNPC inclus dans cette analyse.
Au total, 54 patients (10 tumeurs et 19 histologies différentes) ont été inclus dans l’analyse pour l’étude d’efficacité, dont 10 CBNPC. L’âge médian de la population globale était de 58 ans, 59 % étaient des femmes, majoritairement PS 0-1, en 1re ligne de traitement pour 1/3 d’entre eux, majoritairement en postchimiothérapie pour les patients prétraités. La proportion de métastases cérébrales était de 22 % à l’inclusion. La durée de suivi moyenne était de 12,9 mois.
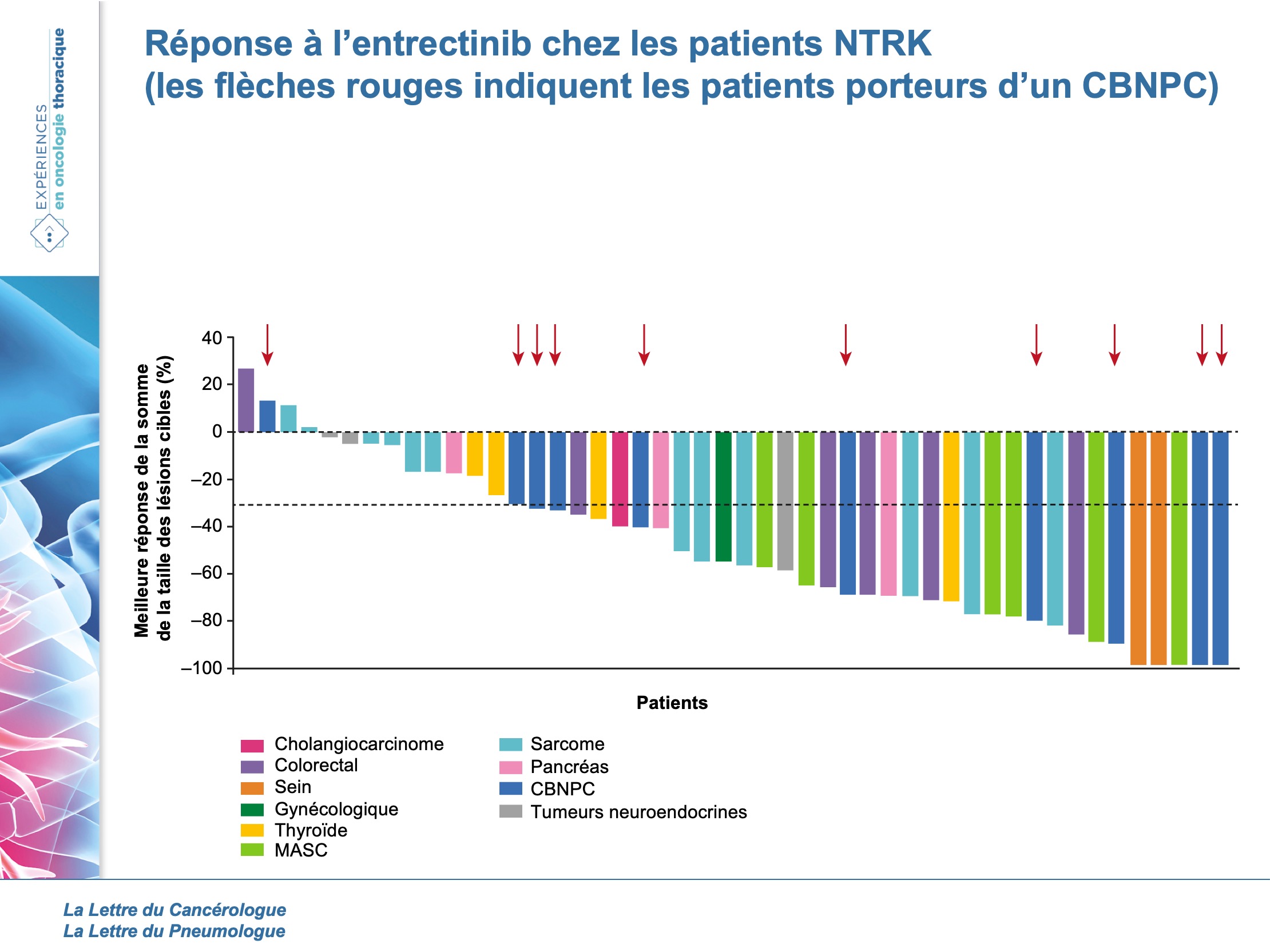
Ainsi, le taux de réponse objective était de 57 et de 55 % au niveau cérébral. Parmi les 10 CBNPC, le taux de réponse était de 80 % avec 2 réponses complètes et 6 réponses partielles. Les 2 autres patients étaient stables selon les critères RECIST1.1. Aucune progression d’emblée n’a été observée (figure 2).
Enfin, l’analyse de la tolérance a été conduite chez l’ensemble de la population évaluable, soit au total 355 patients traités par entrectinib, quel que soit le type tumoral, la dose ou la durée minimale de traitement.
Les effets secondaires grade 1-2 rapportés étaient principalement à type de dysgueusie, malaise, fatigue et troubles du transit. Les toxicités grade 3-4 (35 %) les plus fréquentes étaient une prise de poids (5 %) et une anémie (5 %). 9 % d’effets secondaires sévères liés au traitement ont été rapportés, avec essentiellement des atteints neurologiques (3 %) ainsi que des toxicités cardiaques. Au total, 27 % ont dû bénéficier d’une réduction de dose, 25 % d’une interruption de dose et 4 % d’un arrêt de traitement.
L’entrectinib se présente donc comme une option thérapeutique extrêmement prometteuse chez ces patients porteurs d’un CBNPC ROS1+ ou NTRK+, avec une bonne efficacité cérébrale et une tolérance acceptable. Ainsi, la recherche de ces altérations moléculaires doit être faite de façon systématique lors du screening moléculaire initial pour ROS1 et a minima en l’absence d’autre driver oncogénique identifié pour NTRK afin d’offrir aux patients les meilleures options de traitement. À ce jour, l’entrectinib a été validé par la FDA mais n’est pour le moment disponible en France que dans le cas d’essais thérapeutiques.
Ce que ces deux articles apportent à ma pratique :
- Inhibiteur ciblé, de ROS1 et de NTRK, efficace sur le plan systémique et cérébral,
- Recherche systématique par des techniques et des panels adaptés de ces altérations moléculaires ciblables,
- Inclusion dans des essais thérapeutiques.
Références
1. Michels S et al. Safety and efficacy of crizotinib in patients with advanced or metastatic ROS1-rearranged lung cancer (EUCROSS): A european phase II clinical trial. J Thorac Oncol 2019;14:1266-76.
2. Schram AM et al. Fusions in solid tumours: diagnostic strategies, targeted therapy, and acquired resistance. Nat Rev Clin Oncol 2017;14:735-48.
3. Patil T et al. The incidence of brain metastases in stage IV ROS1-rearranged non-small cell lung cancer and rate of central nervous system progression on crizotinib. J Thorac Oncol 2018;13:1717-26.
4. Drilon A et al. Entrectinib in ROS1 fusion-positive non-small-cell lung cancer: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020;21:261-70.
5. Doebele R, Drilon A, Paz-Ares L et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumors: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020,21:271-82.
















