Étude de phase III CASPIAN : actualisation des résultats du durvalumab avec ou sans trémélimumab + CT vs CT seule en 1re ligne de CBPC à un stade avancé
L’étude CASPIAN est une étude de phase III multicentrique (209 sites, 23 pays) et en ouvert évaluant l’intérêt du durvalumab (Ac anti-PD-L1) +/- trémélimumab (Ac anti-CTLA-4) en association à la chimiothérapie dans les CBPC de stade disséminé. Les patients étaient randomisés selon un ratio 1:1:1 pour recevoir :
- chimiothérapie (CT) seule : étoposide 80-100 mg/m² (J1 à3 ; [J1 = J21]) + carboplatine (AUC 5 ou 6) ou cisplatine (75-80 mg/m²) (J1 ; [J1 = J21]) ; 4 à 6 cycles, puis IPC au choix de l’investigateur ;
- CT + durvalumab 1 500 mg (J1 ; [J1 = J21]) ; 4 cycles puis maintenance par durvalumab, IPC au choix de l’investigateur ;
- CT + durvalumab 1 500 mg (J1 ; [J1 = J21]) + trémélimumab 75 mg (J1 ; [J1 = J21]) ; 4 cycles puis maintenance par durvalumab.
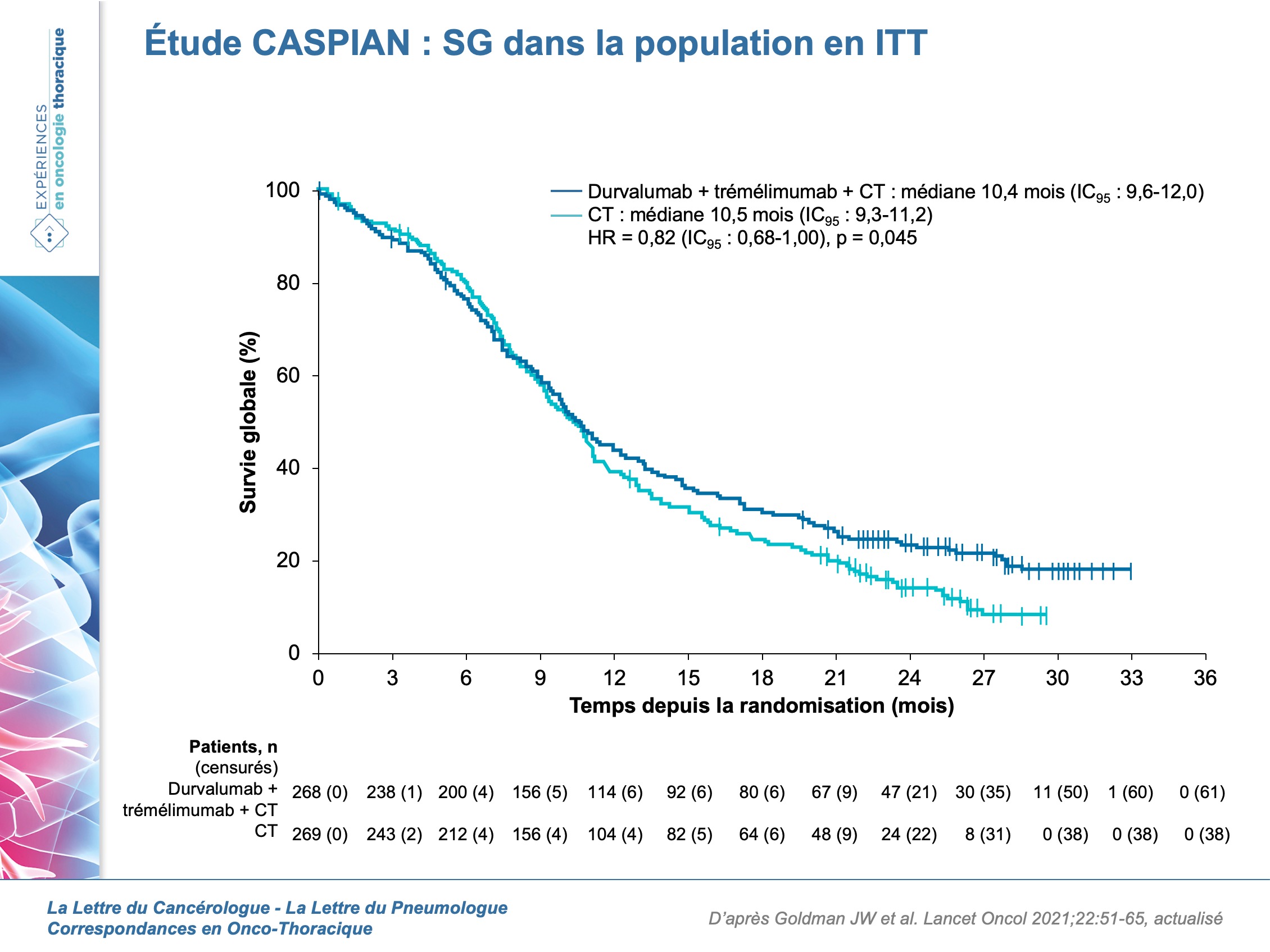
Étaient inclus les patients atteints d’un CBPC de stade avancé, PS 0 ou 1, éligibles à une première ligne de chimiothérapie sans sélection selon le statut PD-L1. Les patients porteurs de métastases cérébrales asymptomatiques ou traités et stables pouvaient être inclus. Les critères d’exclusion comprenaient une irradiation thoracique antérieure, une pathologie auto-immune, une immunodépression ou une infection active. Le critère de jugement principal était la survie globale en ITT et les critères secondaires la SSP, le taux de réponse et la sécurité des traitements. Ce sont les résultats actualisés qui ont été publiés en janvier 2021 dans Lancet Oncology [1]. Entre mars 2017 et mai 2018, 972 patients ont été screenés et 805 randomisés pour recevoir : durvalumab + trémélimumab + CT (n = 268) ; durvalumab + CT (n = 268) ou CT seule (n = 269). Au 27 janvier 2020, le suivi médian était de 25,1 mois (22,3-27,9). Les résultats ne montrent pas d’amélioration significative de la SG dans le bras durvalumab + trémélimumab + CT vs CT seule (HR = 0,82 ; IC95 : 0,68-1,00 ; p = 0,045) avec une médiane de SG de 10,4 mois (IC95 : 9,6-12,0) vs 10,5 mois (IC95 : 9,3-11,2) (figure 1).
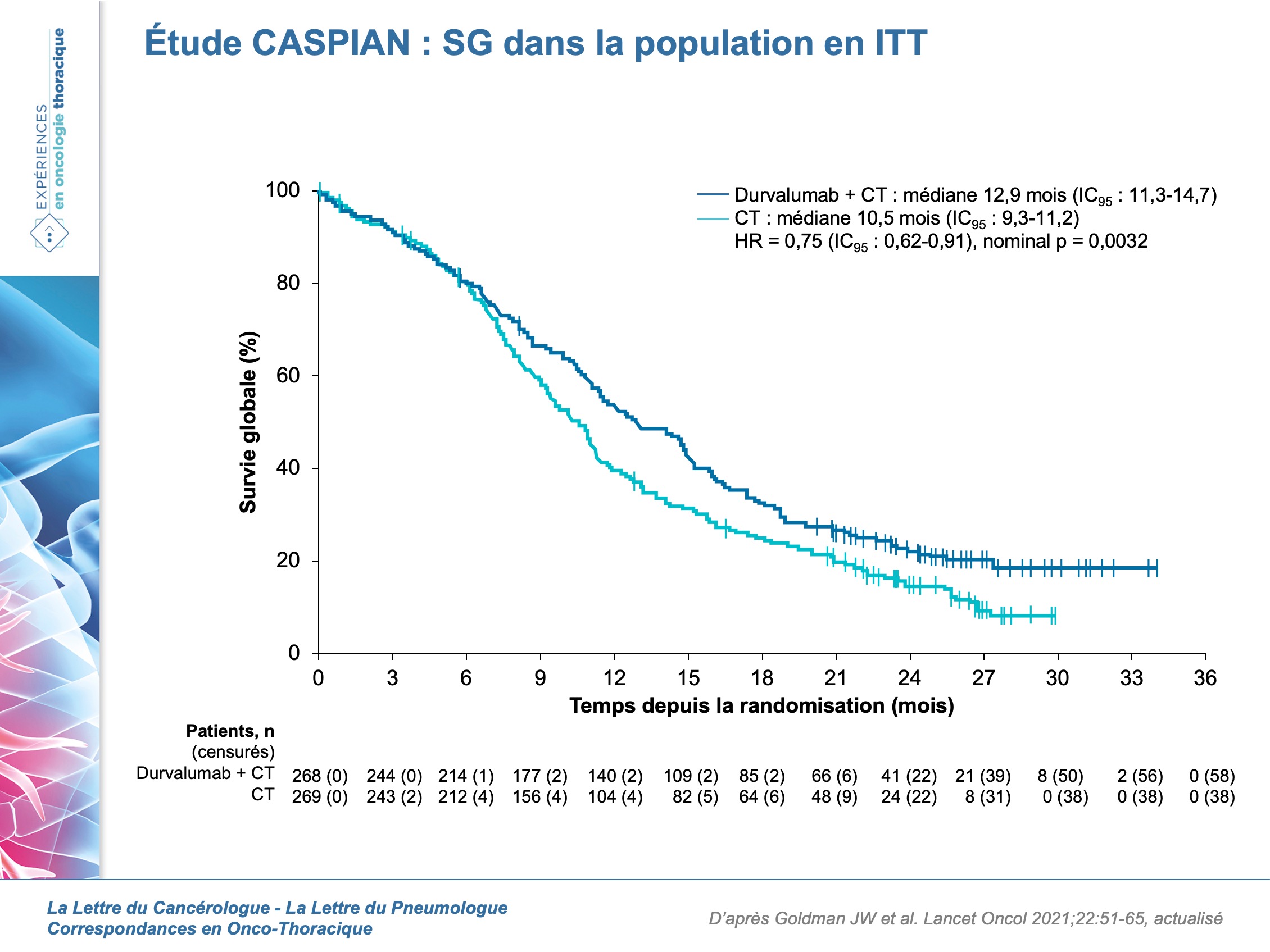
En revanche, la SG est significativement améliorée dans le bras durvalumab + CT vs CT seule (HR = 0,75 ; IC95 : 0,62-0,91 ; p nominal = 0,0032) avec une médiane de SG de 12,9 mois (IC95 : 11,3-14,7) vs 10,5 mois (IC95 : 9,3-11,2) (figure 2). La SG à 18 mois est de 30,7 % (durvalumab + trémélimumab + CT), 32 % (durvalumab + CT) vs 24,8 % (CT). La SSP médiane à 12 mois est de 16,9 % (durvalumab + trémélimumab + CT), 17,9 % (durvalumab + CT) vs 5,3 % (CT). Dans cette analyse post-hoc, la réponse objective demeure plus élevée dans le bras durvalumab + CT (68 %) vs CT seule (58 %) et la durée médiane de réponse est comparable pour tous les bras.
Les principaux effets indésirables (EI) de grade 3 ou plus sont les neutropénies (durvalumab + trémélimumab + CT, 32 % ; durvalumab + CT, 24 % ; CT, 33 %) et les anémies (respectivement 13 %, 9 % et 18 %) donc pas de sur-toxicité inattendue en comparaison à la chimiothérapie seule et même un avantage en faveur de la combinaison durvalumab + CT. Les EI sérieux ont été rapportés chez 45 % (durvalumab + trémélimumab + CT), 32 % (durvalumab + CT) et 36 % (CT) des patients.
Ce que cet article apporte à ma pratique :
- Ces résultats confirment la place du durvalumab en 1re ligne, en association à la chimiothérapie, suivie d’une maintenance, dans les CBPC disséminés.
- Ils corroborent ceux de l’étude IMpower-133 (atézolizumab + chimiothérapie) avec un groupe contrôle plus proche de la pratique clinique : possibilité de faire jusqu’à 6 cycles de chimiothérapie, de proposer du cisplatine et de réaliser une IPC (exclusivement dans le groupe contrôle).
- Ils ne montrent pas d’avantage à l’ajout du trémélimumab.
- Ces données positionnent le durvalumab en alternative à l’atézolizumab en association à la chimiothérapie en 1re ligne dans les CBPC disséminés.
Références
1. Goldman JW et al. Durvalumab, with or without tremelimumab, plus platinum–etoposide versus platinum–etoposide alone in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): updated results from a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2021;22:51-65.
















