Actualité thérapeutique dans la dermatite atopique
Guttman a présenté dans cette communication orale les nouveaux développements de molécules dans la dermatite atopique et les résultats récents des principales études.
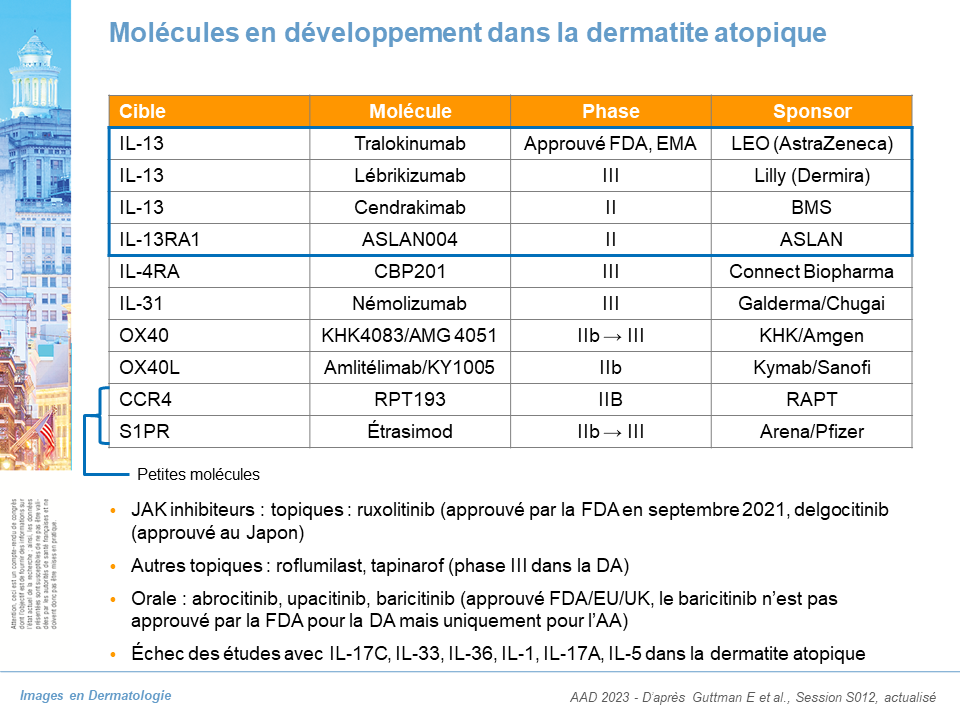
Les grandes lignes sont rapportées dans cet article.
Dupilumab (Anti IL-4-13) : dans la population pédiatrique :
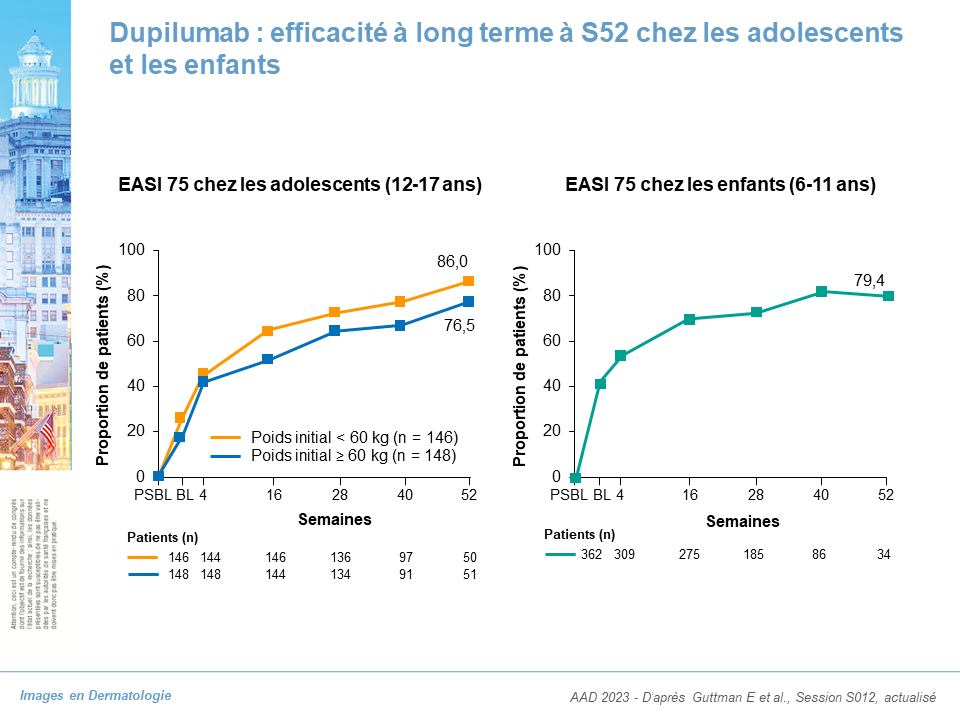
- 6-17 ans : données de maintien d’efficacité à S52
- 12-17 ans : EASI 75 = 86 % (enfant < 60 kg), 76,5 % (enfant > 60 kg)
- 6-11 ans : EASI 75 = 79,4%
- Tolérance :
- Conjonctivite : 8,7 % dans le groupe 12-17 ans, 11,3 % dans le groupe 6-11 ans
- Risque d’infection identique à celui de l’adulte
- Pas d’indication à une surveillance biologique (comme pour l’adulte)
Le Dupilumab bénéficie déjà d’une AMM en France pour cette tranche d’âge.
6 mois-5 ans : Dupilumab + dermocorticoïdes
Étude Liberty AD preschool, données à S16 :
- IGA 0/1 : 28 % p < 0,001
- EASI 75 : 63 % p < 0,001
- Effets indésirables : pas de différence significative versus placebo + dermocorticoïdes
Le Dupilumab est actuellement disponible en France en demande d’accès précoce dès l’âge de 6 mois.
Le Dupilumab est actuellement le seul médicament biologique utilisable chez l’enfant avec une dermatite atopique sévère ne répondant pas au traitement local dès l’âge de 6 mois.
Lébrikizumab (anti-IL-13) : études de phaseIII ADvocate 1 et Advocate 2
- Données à S16 : EASI 75 = 59,3 % ADvocate 1, 50,8 % ADvocate 2.
- Données à S52 : maintien de l’EASI 75 chez les patients répondeurs à S16 = 79 % quelle que soit la dose (ADvocate 1), 85 % dose 250 mg tous les 15 j ; 77 % dose de 250 mg toutes les 4 semaines (ADvocate 2).
- Tolérance : conjonctivite 14 % (ADvocate 1), 15 % (ADvocate 2).
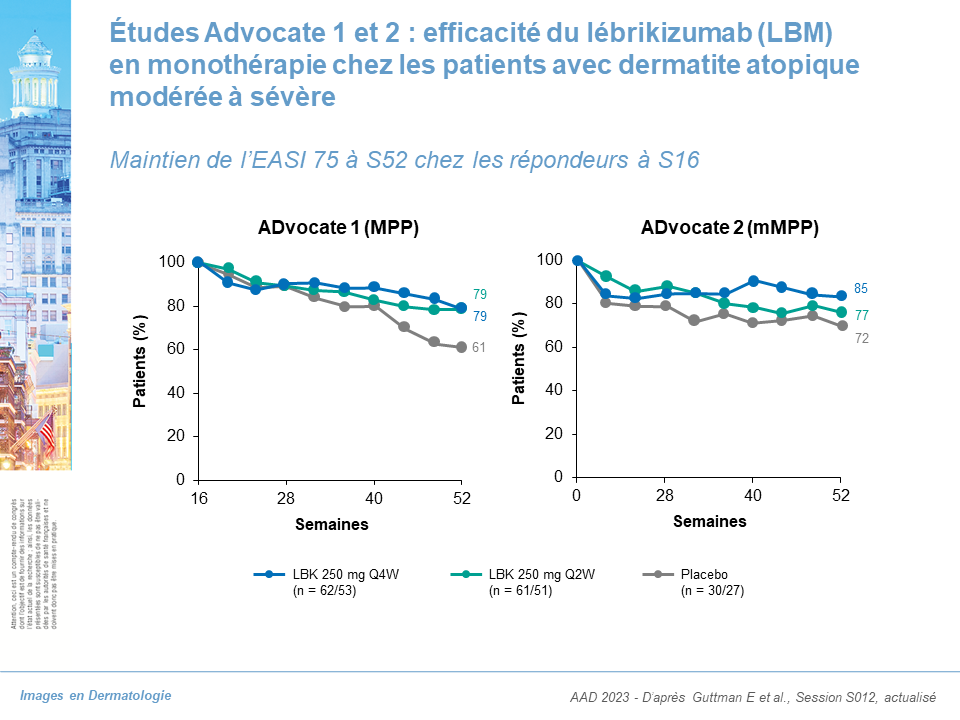
Maintien de l’efficacité du lébrikizumab de S16 à S52 chez les patients répondeurs à S16. Efficacité quasiment identique entre les 2 doses étudiées. Action rapide : différence statistiquement significative dès S4.
Tralokinumab (anti-IL-13) :
étude ECZTEND OLE : données à S56 (patients des études ECZTRA 1,2,3 et 5)
- EASI 75 : 82,8 %
- Tolérance :
- effets indésirables sévères : 2 % à 5 % selon les études ;
- conjonctivites : 6 à 8 % selon les études.
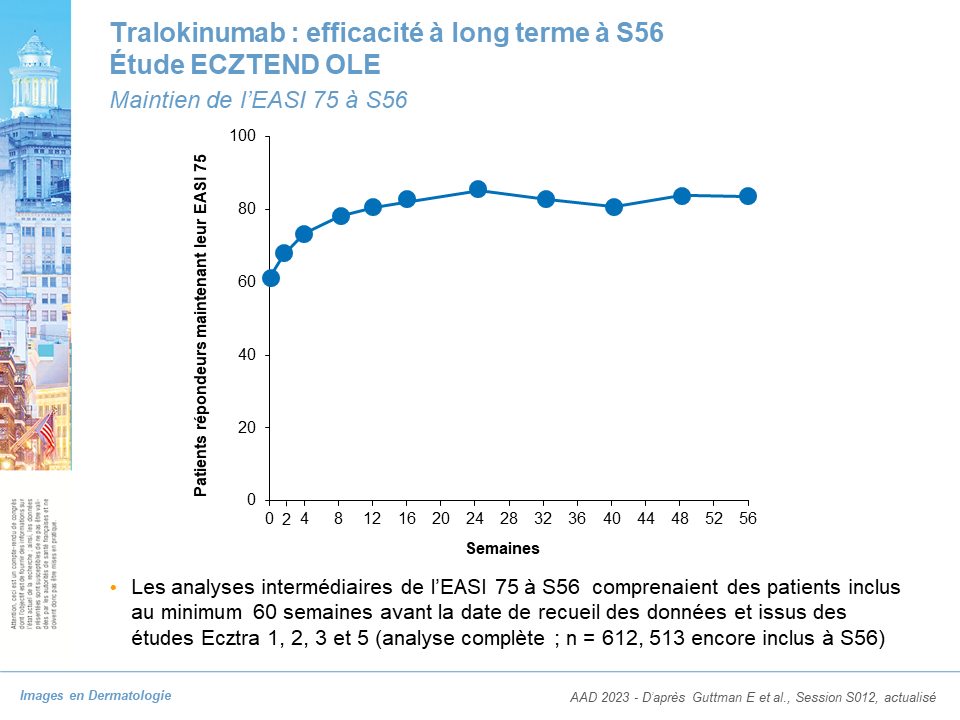
L’efficacité du tralokinumab se maintient au cours du temps avec un profil de tolérance rassurant en particulier sur le risque de conjonctivite qui semble moins important qu’attendu.
Inhibiteur de l’IL-22RA1 : LEO 8559
Étude de phase IIa : données à S16 sur 58 patients (29 groupe LEO 8559, 29 groupe placebo).
- Rationnel : augmentation des taux d’IL-22 dans la dermatite atopique ce qui contribue à l’hyperplasie épidermique et à l’altération de la barrière cutanée
- EASI 75 : 42 % ; p = 0,001
- Tolérance : aucun effet indésirable sévère.
OX40, super famille des récepteurs au TNF : nouvelle cible thérapeutique dans la DA avec 2 études.
- Rationnel : le blocage de OX40 établit l’homéostasie immunitaire sans déplétion des cellules T par suppression de l’effet pro-inflammatoire des T effecteurs mais en maintenant l’effet anti-inflammatoire des T régulateurs. Blocage de la voie TH2 et TH1/17/22.
- KHK4083, antagoniste de l’OX40 : étude de phase IIb : données à S16
- EASI 75 : 53,8 %
- EASI 75 à S36 soit 20 semaines après l’arrêt du traitement : 63.5% pour la dose à 300 mg tous les 15 jours
- Amlitélimab : antagoniste de OX 40Ligand : éÉtude de phase IIa : données à S16
- Modification du score EASI : -70 pour la dose de 250 mg toutes les 4 semaines avec un maintien de l’amélioration clinique jusqu’à S36 pour une dernière dose de traitement à S16.
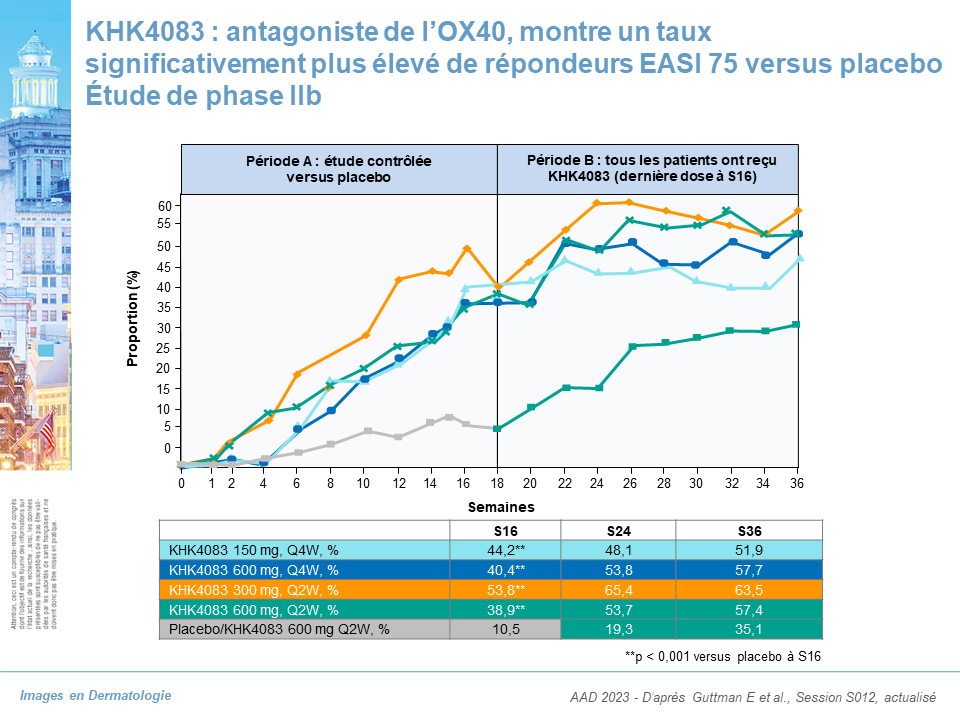
Le blocage de l’OX40 permet une amélioration de la dermatite atopique à S16 avec maintien d’une bonne réponse plusieurs mois après la dernière dose.
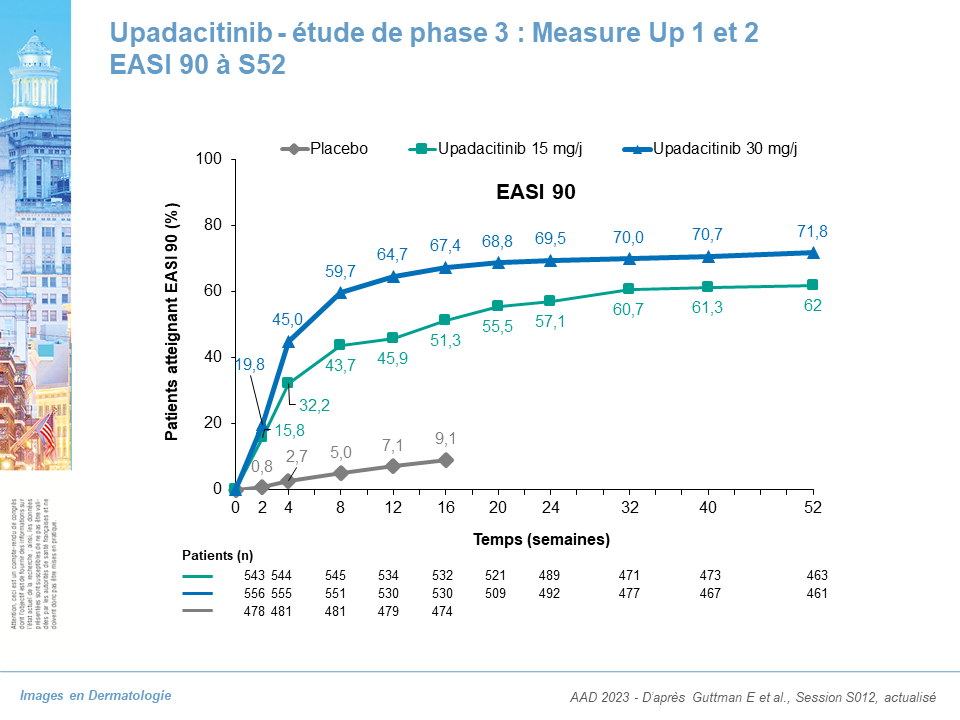
Upadacitinib (JAK1i), étude de phase III Measure Up et 2 : données à S52
- EASI 75 : 81 % pour Upa 15 mg, 85 % pour Upa 30 mg
- EASI 90 : 62 % pour Upa 15 mg, 71,8 % pour Upa 30 mg
- Effets indésirables les plus fréquents : acné, infections ORL hautes, rhinopharyngites et céphalées
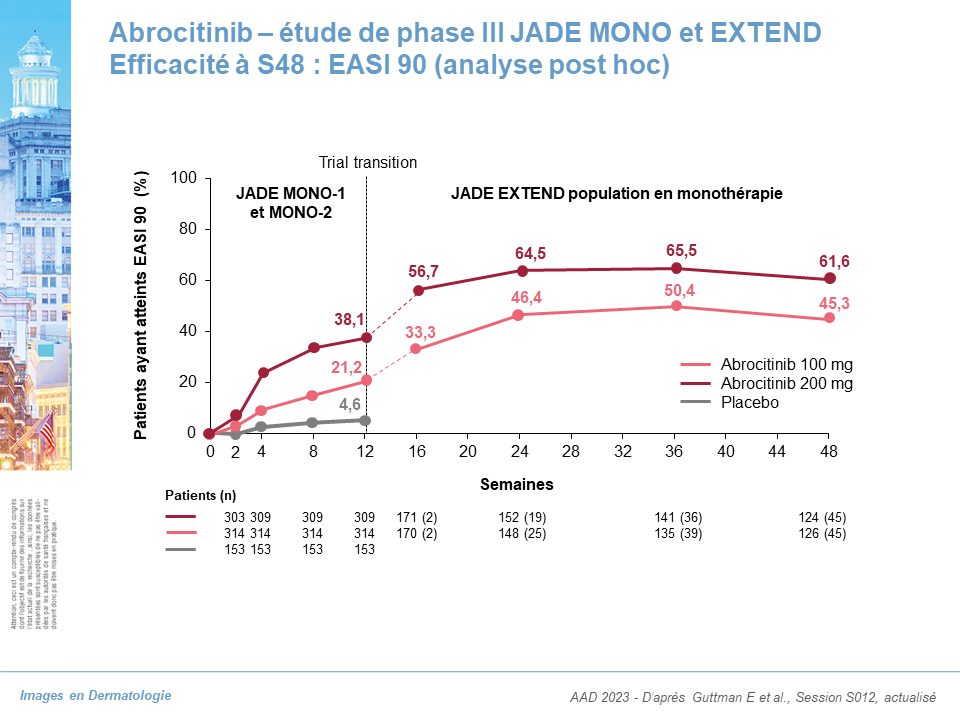
Abrocitinib (JAK1i) : Etudes de phase III JADE MONO et EXTEND : données à S48
- EASI 75 : 68 % pour Abro 100 mg, 87 % pour Abro 200 mg
- EASI 90 : 45,3 % pour Abro 100 mg, 61,6 % pour Abro 200 mg
- Effets indésirables les plus fréquents : acné, rhinopharyngites et céphalées
Concernant les traitements topiques
- Ruxolitinib inhibiteur sélectif de JAK1 et 2 topique pour la DA légère à modérée des adultes et adolescents : à S8, EASI 75 = 62 % pour Rux 1,5 % avec un bon profil de tolérance versus placebo
- Topinarof agoniste du récepteur aryl hydrocarbone topique à 1 % : étude de phase III
A S8 : critère principal atteint pour 46,4 % p < 0,0001 versus placebo. Folliculite plus fréquente dans le groupe topinarof topique et plus d’effets indésirables ayant conduit à l’arrêt du traitement dans le groupe placebo
- Roflumilast topique 0,15 %, à S4 : critère principal atteint pour 32 % p < 0,0001 (étude INTEGUMENT 1) et 29 % p < 0,0001 (étude INTEGUMENT 2) versus placebo
Cette communication orale riche en résultats est encourageante avec de nombreuses molécules à des stades de développement avancé et des études utilisant des critères d’évaluation de plus en plus stricts (EASI 90) sur du long terme avec des résultats très positifs. De nouvelles molécules d’intérêt semblent émerger et sont en phase de développement plus précoce. Il est donc fort probable que les possibilités thérapeutiques concernant la dermatite atopique vont encore s’étoffer dans les années à venir.





