CBP-201 : un anticorps monoclonal humanisé anti-IL-4Rα de nouvelle génération dans la dermatite atopique modérée à sévère de l’adulte. Étude pivot : données d’efficacité et de tolérance à S16
CBP-201 est un anticorps monoclonal humanisé anti-IL-4Rα de nouvelle génération bloquant les voies de l’IL-4 et IL-13 et ayant une affinité plus importante que le dupilumab.
Dans une étude de phase II dans la dermatite atopique modérée à sévère de l’adulte, le CBP-201 permettait une amélioration rapide des symptômes quelle que soit le schéma d’administration (tous les 15 jours ou toutes les 4 semaines) et sans plateau d’efficacité après 16 semaines de traitement.
Le CBP-201 est ici évalué dans un essai pivot randomisé en double aveugle : CN002 chez les patients adultes atteints de dermatite modérée à sévère. Les résultats d’efficacité et de tolérance à S16 sont rapportés par les auteurs lors de cette communication orale.
Schéma de l’étude CN002 :
- Population inclue : 18-75 ans, avec dermatite atopique depuis 1 an, IGA ≥ 3, EASI ≥ 16, BSA ≥ 10 %, PP NRS ≥ 4 : 255 patients
- CBP-201 : J1 600 mg puis 300 mg tous les 15 jours : 170 patients
- Versus placebo : 85 patients
- Évaluation à S16
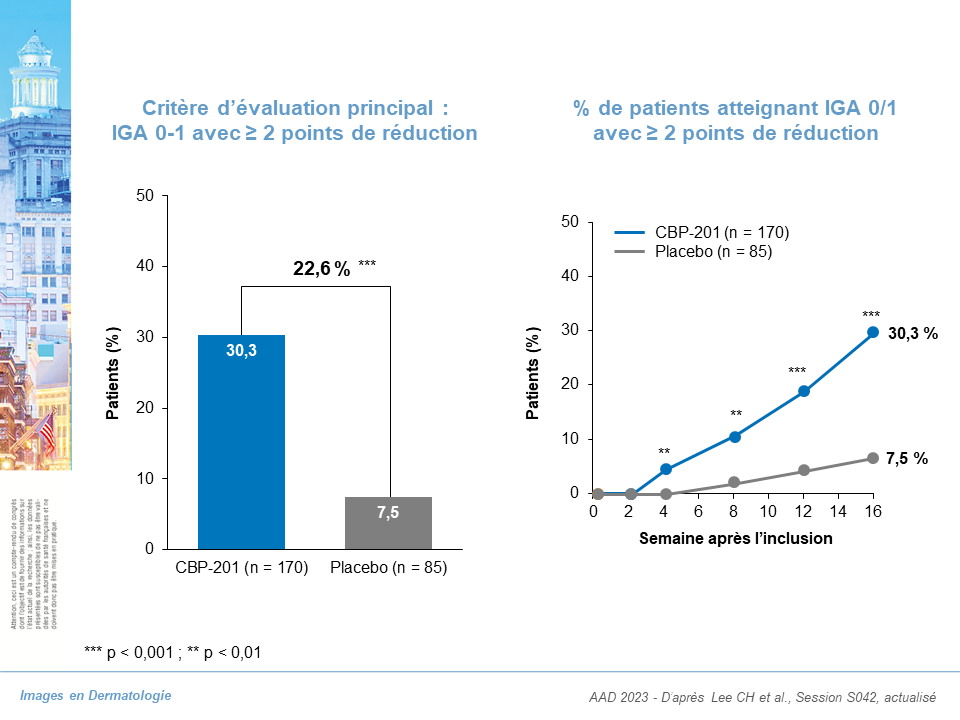
- Critère d’évaluation principal : % de patients avec IGA 0-1 et diminution de ≥ 2 points de l’IGA initial.
- S16 : évaluation de 241 patients : 95,3 % des patients du bras CBP-201, 92,9 % des patients du bras placebo
Critère principal d’évaluation : IGA 0-1 et diminution de ≥ 2 points de l’IGA initial :
- Bras CBP-201 : 30,3 %
- Bras placebo : 7,5 %
- p < 0,001
- Avec une différence significative p < 0,01 dès S4 et l’absence d’effet plateau à S16
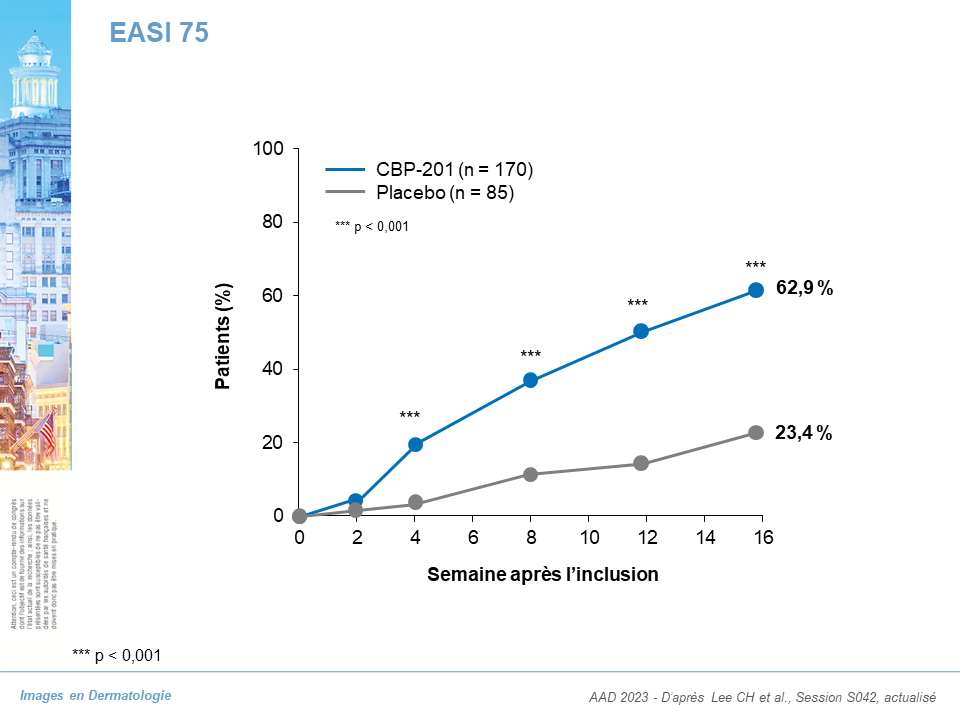
EASI 75 à S16 :
- Bras CBP-201 : 62,9 %
- Bras placebo : 23,4 %
- p < 0,001
- Avec une différence significative p < 0,001 dès S2 et l’absence d’effet plateau à S16.
PP-NRS ≥3 points de réduction à S16 :
- Bras CBP-201 : 46,7 %
- Bras placebo : 16,7 %
- p < 0,001
- Avec une amélioration dès S1
Données de tolérance :
- Effets indésirables : bras CBP-201 : 73,5 %, bras placebo : 72,9 %
- Effets indésirables rapportés aux traitements : bras CBP-201 : 31,8 %, bras placebo : 23,5 %
- Effets indésirables sévères grade 3 : bras CBP-201 : 2,4 %, bras placebo : 5,9 %
- Effets indésirables d’intérêt :
- conjonctivites : bras CBP-201 : 4,7 %, bras placebo : 3,5 %
- douleur aux points d’injections : bras CBP-201 : 6,5 %, bras placebo : 0 %
- une réaction anaphylactique dans le bras CBP-201 non rapportée à la molécule
CBP-201 semble un traitement prometteur dans la prise en charge de la dermatite atopique modérée à sévère de l’adulte avec des réponses rapides et maintenues à S16 sans effet plateau obtenu à cette date, laissant supposer une efficacité encore supérieure au cours du temps. Le profil de tolérance semble identique à celui des anti-IL-4Rα déjà disponibles. Les données de maintenance à S36 de cette molécule sont attendues avec grand intérêt.





