COLUMBA : les patients vous diront MERCI
Le daratumumab est incontestablement en ce moment, le grand champion du myélome multiple. Cet anticorps monoclonal, dirigé contre le CD38, est déjà approuvé en rechute dans différentes combinaisons, mais également en 1ère ligne chez les sujets âgés. L’inconvénient majeur du daratumumab, est sa modalité d’administration intraveineuse qui peut durer plusieurs heures, notamment lors de la 1ère injection. Ceci représente une gêne importante pour les malades et encombre fréquemment nos services hospitaliers. C’est en partant de ce constat, que le daratumumab dans une formulation sous cutanée, a été développé en utilisant la protéine recombinante PH20 (technique dite inhanze®). Une étude de phase 1b dite « PAVO » avait établi qu’une dose unique de 1800 mg de daratumumab sous-cutané pourrait être efficace avec une pharmacocinétique comparable à celle du daratumumab intraveineux.
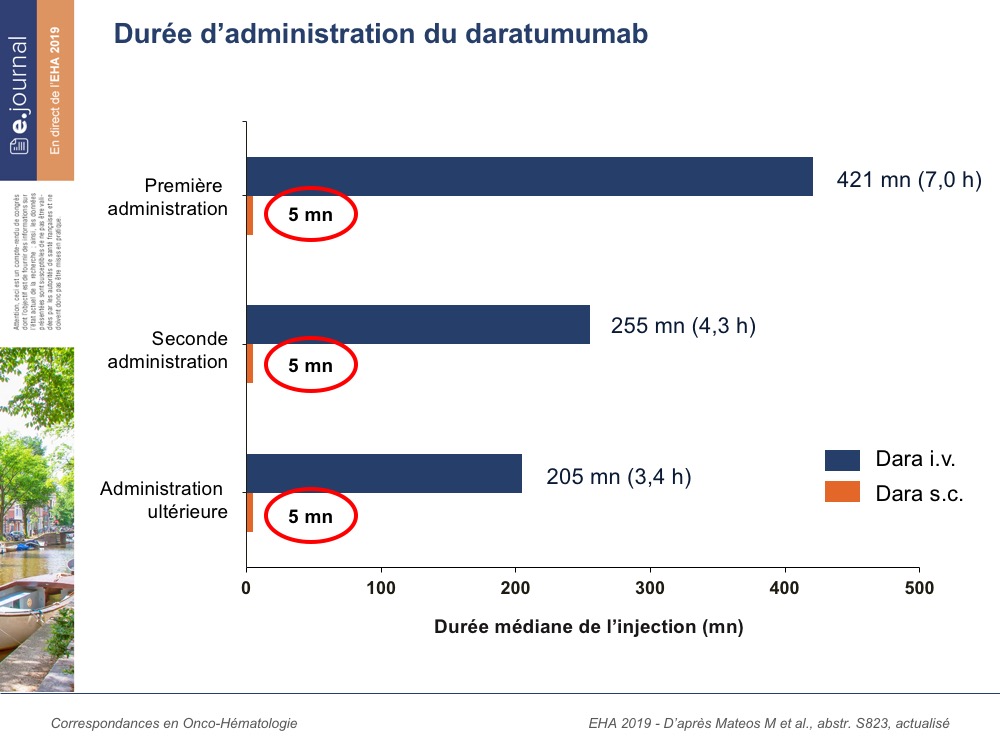
L’étude COLUMBA, présentée par Mateos et al, est une étude de phase III randomisée ayant un objectif de non infériorité, et qui a comparé une concentration unique de daratumumab 1800mg sous-cutané, par rapport au schéma classique de daratumumab intraveineux chez des patients ayant un myélome en rechute. Un total de 522 malades a été inclus. L’objectif primaire de l’étude est celui de non infériorité du taux de réponse, ainsi que l’équivalence en termes de concentration maximale et de pharmacocinétique. S’agissant d’une étude randomisée de phase III, la quasi-totalité des caractéristiques démographiques et cliniques entre les deux groupes était comparable. Pour ce qui est des données de sécurité d’administration, là aussi les deux groupes étaient comparables. Il existe par contre une différence significative en termes de durée d’administration puisque, lors de la 1ere injection, la durée médiane d’injection du daratumumab intraveineux était de 421 minutes, versus 5 minutes pour la forme sous cutanée. Lors de la 2ème injection, le daratumumab intraveineux a nécessité 255 minutes, versus 5 minutes pour la forme sous cutanée, et lors des injections ultérieures, on reste pour la daratumumab intraveineux aux alentours de 205 minutes, versus 5 minutes pour la forme sous cutanée. L’objectif primaire est atteint et on retrouve un taux de réponse globale du daratumumab en sous cutané non inférieur au daratumumab intraveineux, et les réponses supérieures ou égales à VGPR ou supérieures ou égales à CR sont également comparables entre les deux groupes. En termes de concentration maximale, il n’existe pas de différence et ce co-objectif primaire a été également atteint. Lors de l’analyse des différents sous-groupes, tous les résultats permettent d’établir la non-infériorité de la forme sous cutanée. En particulier, on peut souligner que le dosage unique de la forme sous cutanée est tout aussi efficace quel que soit le poids du patient considéré. Enfin, il n’y a aucune différence significative de PFS ou d’OS entre les deux groupes. En ce qui concerne les réactions liées à l’injection du daratumumab, l’incidence de ces réactions est significativement inférieure avec le daratumumab sous cutané, ce qui lui confère encore un grand avantage. Comme attendu, les questionnaires de satisfaction des patients sont nettement en faveur de la forme sous cutanée du fait de la très courte durée d’administration et du peu d’effets secondaires.
Au total, cette étude de phase III permet d’installer le daratumumab sous cutané comme une alternative à la forme intraveineuse. Ces résultats vont permettre vraisemblablement l’autorisation d’un dosage unique à 1800 mg de daratumumab sous cutané.
Il est vrai que COLUMBA est une petite constellation de l’hémisphère sud située au sud du grand chien et du lièvre, néanmoins dans le contexte de cette étude les résultats sont grandioses et les patients qui auront essayé le daratumumab intraveineux et qui seront ensuite « switchés » vers la forme sous cutanée, se souviendront beaucoup de cette expérience.