Cibler TIM 3 pour optimiser l’efficacité des agents démethylants dans les syndromes myélodysplasiques de haut risque et les leucémies aiguës myéloïdes
TIM-3 est un immune checkpoint exprimé sur les cellules leucémiques et les blastes mais pas sur les cellules hématopoïétiques normales. Il est une cible intéressante pour MBG453, un anti-TIM3 de haute affinité.
U. Borate et coll. présentent les résultats d’une étude multicentrique de phase 1b d’escalade de dose du MBG453 combiné à un agent hypométhylant (HPM) ; décitabine (Dec) (n = 69) ou azacitidine (AZA) (n = 37) dans des syndromes myélodysplasiques de haut risque (SMD-HR), des leucémies aiguës myéloïdes nouvellement diagnostiqués inéligibles au traitement intensif et des LAM en Rechute ou/Refractaire ne pouvant bénéficier d’une chimiothérapie classique. MBG453 est administré à J8 et J22 de chaque cycle pour les paliers de dose 240 mg et 400 mg et à J8 uniquement pour le palier de dose à 800 mg.
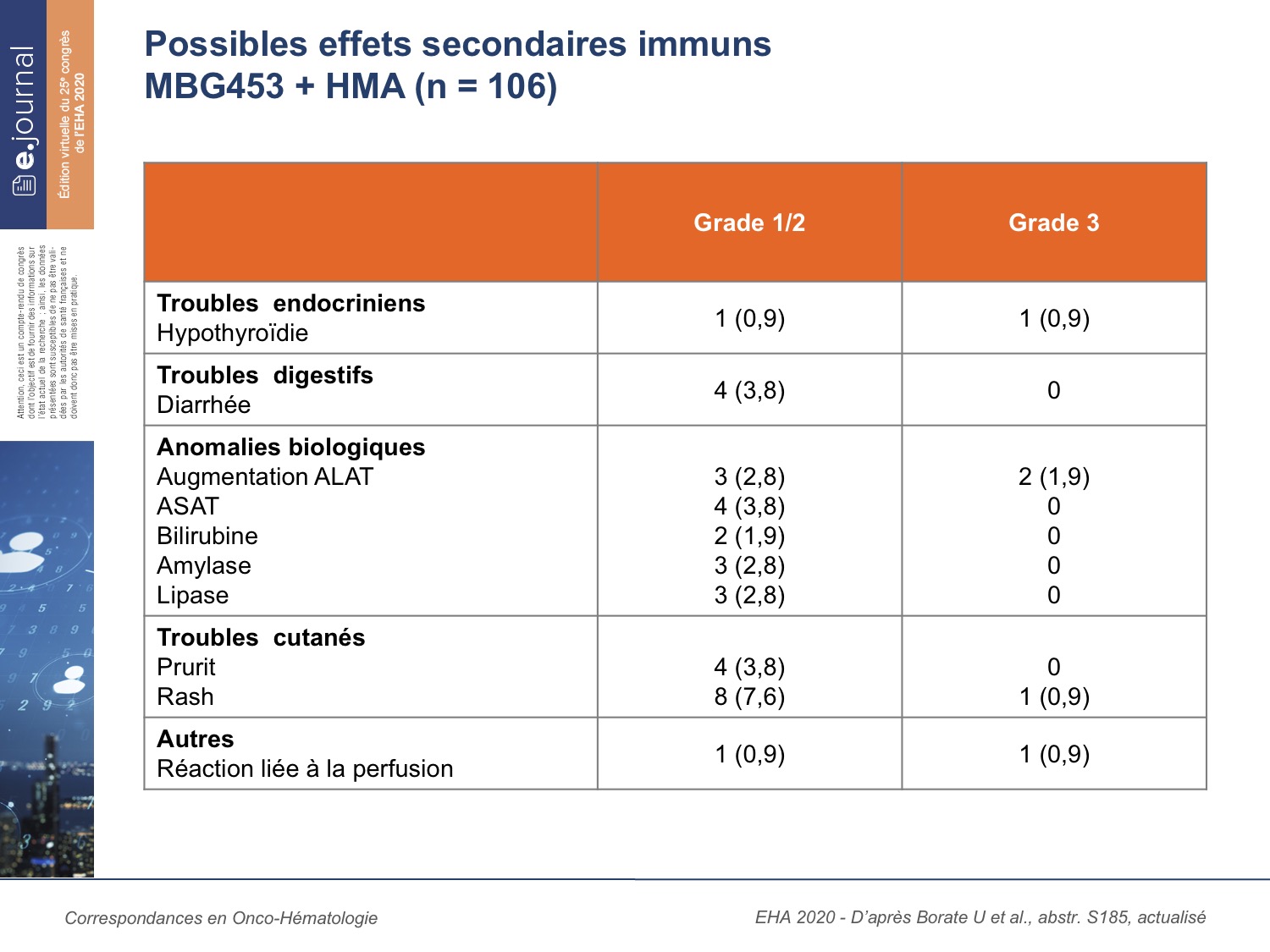
Le profil de tolérance est quasi similaire à celui des HPM seuls. Les effets secondaires observés sont, pour la plupart, de grade 1-2. De possibles effets immuns ont été décrits sans gravité (tableau 1). Il n’y a pas de dose toxique limitante et pas de décès lié au traitement.
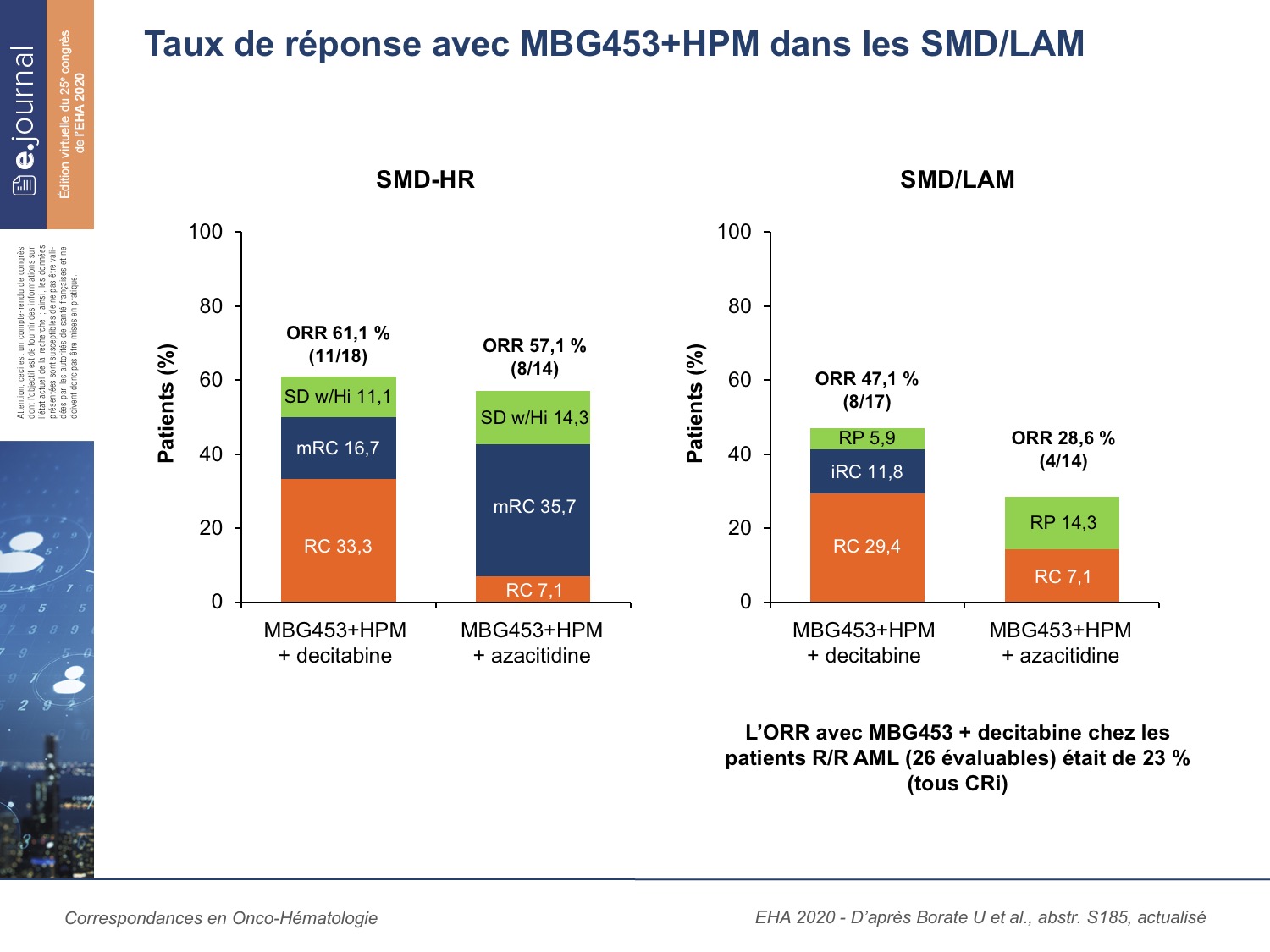
Les taux de réponse globale, de 61 % (Dec) et de 57 % (AZA) sont prometteurs. Toutefois les taux de RC sont assez faibles dans le bras AZA (7,1 %) vs 33,3 % pour le bras Dec. Les différentes réponses obtenues sont détaillées dans le tableau 2. Le temps médian d’obtention de la réponse est court ; 2,1 mois, et respectivement de 2,5 mois pour le bras AZA (1,7-5,1) et de 1,9 mois pour le bras Dec (1,8-9,6). La réponse semble durable avec des pts encore traités pour une médiane de 8 mois (2,1-30,3).
Les réponses ont été observées pour les trois doses de MBG453 dans les deux combinaisons thérapeutiques. Les études de pharmacocinétique sont optimales pour MBG453 400 mg/2 semaines et 800 mg/4 semaines.
Ces résultats permettent la poursuite du développement avec la mise en place d’une étude de phase 3 randomisée AZA+MBG453 vs AZA dans les SMD-HR (STIMULUS -MSD2).