Un anti-HER2 avec activation immunitaire serait-il la clef des cancers du sein métastatiques HER2-positif ? Quand le margétuximab fait mieux que le trastuzumab dans l’essai SOPHIA
La prise en charge du cancer du sein métastatique HER2-positif consiste en la succession d’associations thérapeutiques ciblant HER2 avec soit des anticorps anti-HER2, soit des inhibiteurs de tyrosine-kinase cytoplasmiques, soit des anticorps drogue-conjugués. La place de l’immunothérapie et l’implication du système immunitaire dans la réponse à ces thérapeutiques restent encore imparfaitement connues. Le margétuximab pourrait nous donner quelques indices. Cette immunoglobine monoclonale IgG1 chimérique a la particularité de partager avec le trastuzumab la spécificité cible (épitope) de la partie extracellulaire de HER2 ainsi que l’effet antiprolifératif Fc-indépendant, mais avec une région Fc-modifiée qui potentialise l’activation immunitaire innée et adaptative par rapport au trastuzumab (1-2).
L’essai SOPHIA a comparé l’efficacité clinique de l’association chimiothérapie-margétuximab versus chimiothérapie-trastuzumab pour le cancer du sein métastatique HER2-positif (3). Cet essai de phase III, randomisé, en ouvert, multicentrique, international, a recruté 536 patients en progression après au moins 2 thérapies anti-HER2 et 1 à 3 lignes de traitement en situation métastatique. La présence de métastase(s) cérébrale(s) était permise mais ces dernières devaient être traitées et stables. La randomisation était réalisée avec un ratio 1:1 avec comme bras expérimental margétuximab 15 mg/kg en association à la chimiothérapie et comme bras comparateur trastuzumab 6 mg/kg (dose de charge, 8 mg/kg) en association à la chimiothérapie, chaque bras ayant des cycles de 3 semaines et un partenaire de chimiothérapie unique (capécitabine 1 000 mg/m2 2 fois par jour 14 jours sur 21, éribuline 1,4 mg/m2 J1-J8, gemcitabine 1 000 mg/m2 J1-J8 ou vinorelbine 25-30 mg/m2 J1-J8). Les facteurs de stratification étaient le nombre de sites métastatiques (≤ 2 vs > 2), les lignes de thérapie (≤ 2 vs > 2) et le choix de la chimiothérapie. Le critère de jugement principal était séquentiel avec analyse stratifiée : la survie sans progression (SSP) en aveugle avec analyse centralisée, suivie en cas de positivité par la survie globale (SG). Les critères de jugement secondaires étaient la SSP selon l’investigateur et le taux de réponse objective selon l’analyse centralisée en double-aveugle.
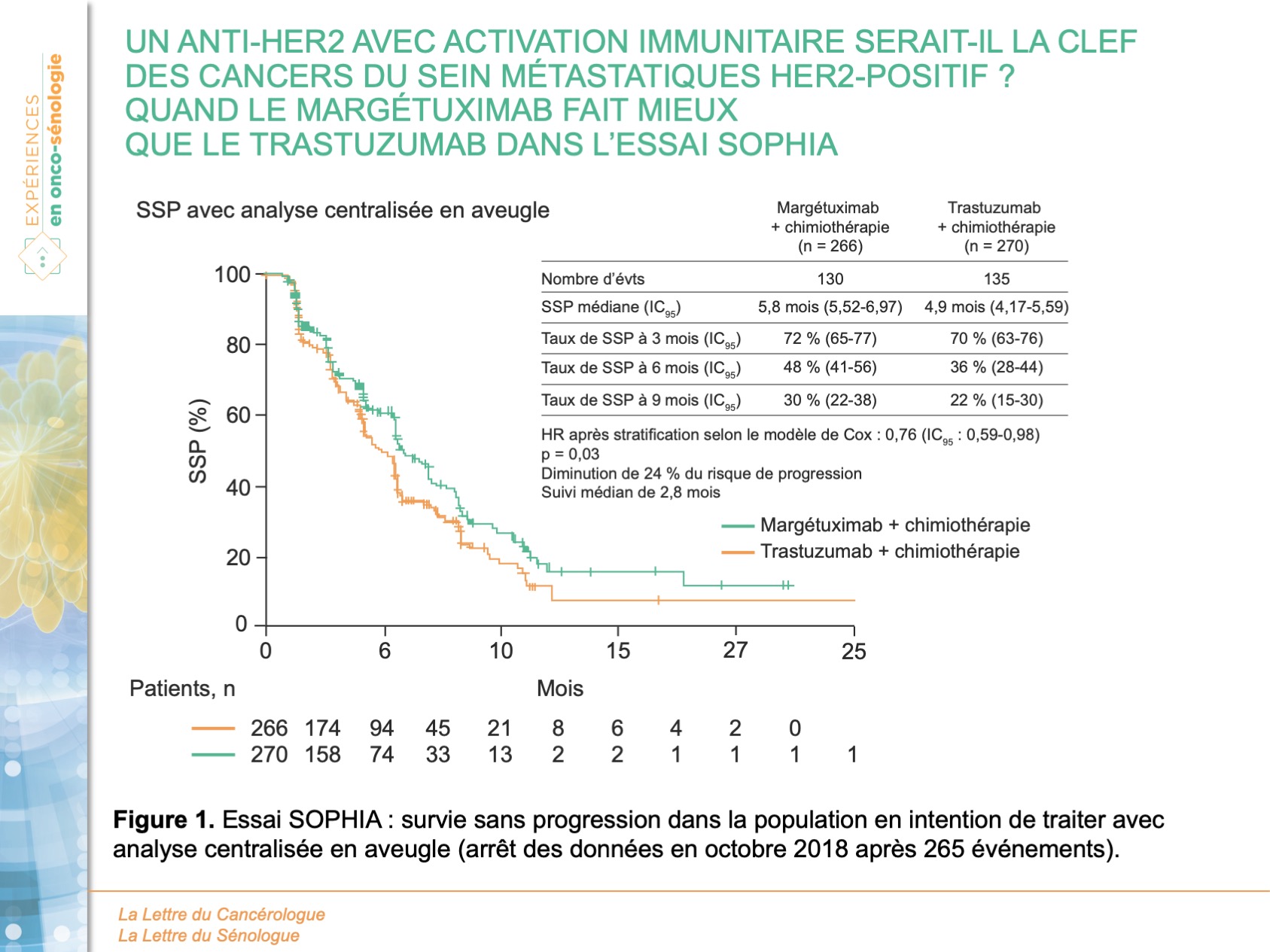
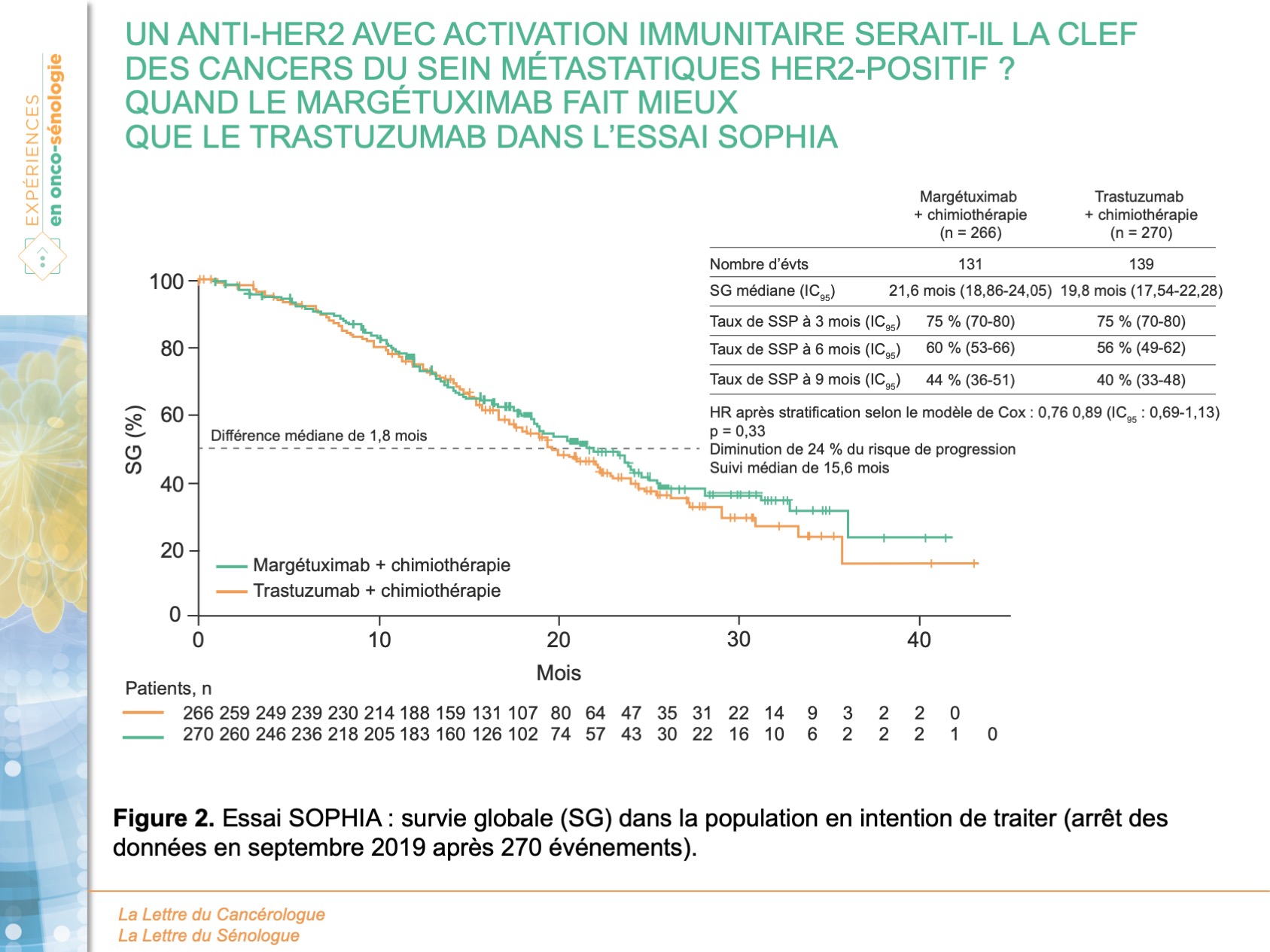
Au total, 536 patients ont été randomisés, 266 dans le bras margétuximab et 270 dans le bras trastuzumab avec un âge médian de 56 ans (27-86). La quasi-totalité (535/536) avaient déjà reçu du pertuzumab, et 489 patients (91,2 %) avaient déjà reçu du trastuzumab-emtansine. Un tiers des patients avaient reçu 3 lignes de traitement ou plus en contexte métastatique. L’association margétuximab-chimiothérapie a montré une amélioration modeste mais statistiquement significative de la SSP (5,8 mois) par rapport à trastuzumab-chimiothérapie (4,9 mois) avec une réduction du risque relatif de 24 % (HR = 0,76 ; IC95 : 0,59-0,98 ; p = 0,03) (figure 1). La durée médiane de SG (analyse intermédiaire n° 2) était de 21,6 mois avec le margétuximab contre 19,8 mois avec le trastuzumab avec une différence non statistiquement significative (HR = 0,89 ; IC95 : 0,69-1,13 ; p = 0,33) (figure 2). La SSP évaluée par l’investigateur a montré une réduction du risque relatif de 29 % en faveur du margétuximab (HR = 0,71 ; IC95 : 0,58-0,86 ; p < 0,001) avec une SSP médiane de 5,7 mois vs 4,4 mois dans les groupes margétixumab et trastuzumab, respectivement. Le margétuximab a également amélioré le taux de réponse objective par rapport au trastuzumab : 25 % contre 14 % (p < 0,001). Le profil de tolérance était similaire entre les 2 groupes, excepté pour les réactions liées à la perfusion plus fréquentes avec le margetuximab (13,3 % vs 3,4 %) et survenant principalement lors du premier cycle.
L’analyse finale de la SG est attendue en 2021 mais malgré ces premiers résultats significatifs au niveau statistique, l’intérêt clinique du margétuximab reste marginal avec un rapport coût/efficacité discutable à l’heure des biosimilaires. Le margétuximab aura probablement une place limitée par rapport au trastuzumab-déruxtécan ou à l’association tucatinib-capécitabine-trastuzumab, tous deux nouvellement sortis en ATU en 2020. Au vu du profil de tolérance favorable, cela pourrait être une alternative pour les patients fragiles. Cela laisse présager de longs débats sur la prise en charge optimale du cancer du sein métastatique HER2-positif en 2021… Ces résultats ont d’ores et déjà conduit en décembre 2020 à une autorisation de la part de la FDA. La France va-t-elle suivre ? Telle est la question...
Références
1. Nordstrom JL et al. Anti-tumor activity and toxicokinetics analysis of MGAH22, an anti-HER2 monoclonal antibody with enhanced Fcγ receptor binding properties. Breast Cancer Res 2011;13(6):R123.
2. Stavenhagen JB et al. Fc optimization of therapeutic antibodies enhances their ability to kill tumor cells in vitro and controls tumor expansion in vivo via low-affinity activating Fcgamma receptors. Cancer Res 2007;67(18):8882-90.
3. Rugo HS et al. SOPHIA Study Group. Efficacy of margetuximab vs trastuzumab in patients with pretreated ERBB2-positive advanced breast cancer: a phase 3 randomized clinical trial. JAMA Oncol 2021 Jan 22:e207932.
















