Prise en charge du cancer du sein N+ RH+/HER2- chez le sujet âgé présentant des comorbidités : chimiothérapie et survie
Le risque de cancer du sein et les comorbidités augmentant avec l’âge (1), le cancer du sein chez le sujet âgé va voir sa fréquence augmenter dans les décennies à venir suite au vieillissement de la population (2). Actuellement, plus d’un cancer sur 4, survient chez des sujets de 75 ans et plus (2). Mieux définir la prise en charge du cancer du sein chez les sujets âgés devient donc essentiel.
Très peu de sujets âgés sont représentés dans les études de chimiothérapie adjuvante. Il est donc difficile d’émettre des recommandations précises (3). Plusieurs méta-analyses ont montré que le bénéfice absolu de la chimiothérapie adjuvante diminue lorsque l’âge augmente mais qu’elle garde son intérêt dans la population âgée sélectionnée selon des critères de gravité tumoraux (4-6). Une chimiothérapie adjuvante peut être proposée après discussion pluridisciplinaire, si le patient est en bon état général (score G8 élevé ≥14) et si des critères de gravité tels qu’un envahissement ganglionnaire, un grade élevé, une taille tumorale importante, sont retrouvés. Dans le cas contraire, l’hormonothérapie adjuvante reste la référence (7). Certains outils peuvent être utilisés pour guider l’administration d’une chimiothérapie adjuvante tel que PREDICT, mais l’évaluation oncogériatrique est absente de l’algorithme avec une probabilité de survie calibrée uniquement sur l’âge du patient (https://breast.predict.nhs.uk).
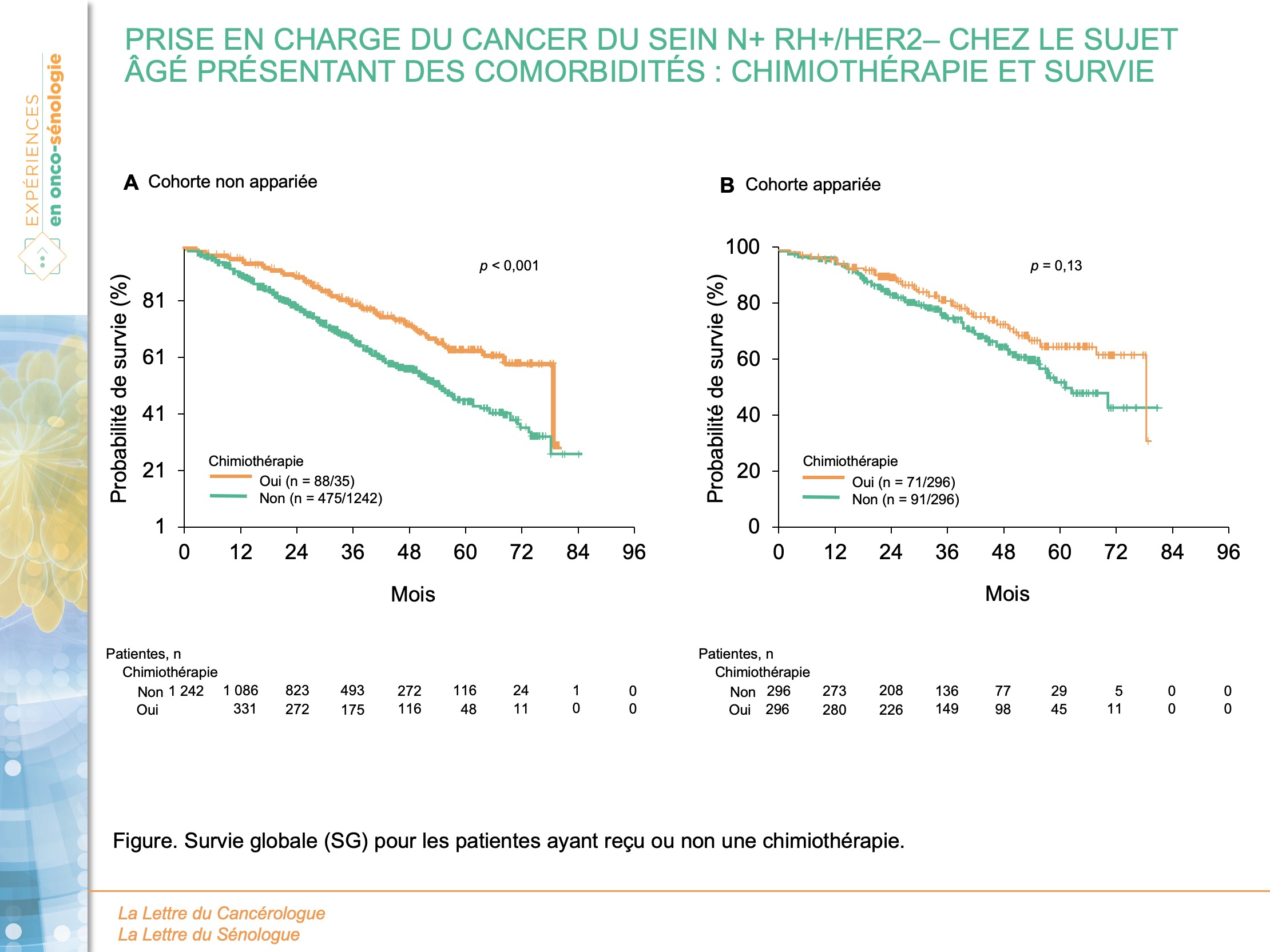
Les données manquent quant à l’impact d’une chimiothérapie adjuvante sur la survie globale des patientes âgées présentant des comorbidités et un cancer du sein RH+ avec envahissement ganglionnaire (N+). Pour répondre à cette question, Tamirisa et al. (8) ont analysé une cohorte rétrospective de 1 592 patients de plus de 70 ans, présentant un cancer du sein RO+/HER2-, N+, Charlson/Deyo score 2-3 et ayant bénéficié d’une chirurgie première entre le 1er janvier 2010 et le 31 décembre 2014 (US National Cancer Database). Des scores de propension ont été utilisés pour apparier les patients recevant une chimiothérapie adjuvante avec ceux ne recevant pas de chimiothérapie adjuvante. Les critères d’appariement étaient l’âge, le score de comorbidité, le type d’établissement, les stades T et N, la réalisation d’une hormonothérapie et/ou d’une radiothérapie adjuvante.
L’âge moyen était de 77,5 ans. Parmi les 1 592 patientes, 350 (22,0 %) et 1 242 (78,0 %) ont reçu ou non une chimiothérapie adjuvante respectivement. Les patientes ayant reçu une chimiothérapie étaient plus jeunes (âge moyen : 74 vs 78 ans ; p < 0,001), avaient un stade T plus élevé (pT3/T4 : 20,6 % vs 14,7 % ; p = 0,005), et un envahissement ganglionnaire plus important (pN3 : 21,4 % vs 8,5 % ; pN1 : 52,0 % vs 75,4 % ; p < 0,001). De plus, les patientes ayant bénéficié d’une chimiothérapie ont également reçu d’autres traitements adjuvants, notamment une hormonothérapie (88,3 % vs 82,5 % ; p = 0,01) et/ou une radiothérapie (67,4 % vs 43,5 % ; p < 0,001).
Dans la cohorte appariée, avec un suivi médian de 43,1 mois, aucune différence statistiquement significative n’a été retrouvée pour la survie globale médiane entre les groupes avec chimiothérapie et sans chimiothérapie (78,9 mois vs 62,7 mois ; p = 0,13) (figure). Après ajustement pour les facteurs de confusion potentiels, la réalisation d’une chimiothérapie était associée à une amélioration de la survie (HR = 0,67 ; IC95 : 0,48-0,93 ; p = 0,02). Les facteurs associés de manière significative étaient le Charlson/Deyo score (3 vs 2 : HR = 1,94 ; IC95 : 1,34-2,79 ; p < 0,001), le stade T (pT4 vs pT1 : HR = 3,51; IC95 : 1,86-6,62 ; p < 0,001), le stade N (pN3 vs pN1 : HR = 1,71 ; IC95 : 1,09-2,69 ; p = 0,04), l’administration d’une hormonothérapie (HR = 0,47 ; IC95 : 0,31-0,72 ; p < 0,001) et la réalisation d’une radiothérapie (HR = 0,61 ; IC95 : 0,43-0,87 ; p = 0,006).
Par conséquent, malgré les comorbidités multiples, les patientes âgées présentant un cancer RO+/HER2–, N+ tireraient bénéfice en termes de SG d’une chimiothérapie adjuvante. La nécessité d’ajustements multiples lors de l’analyse statistique montre cependant que les patientes ayant bénéficié d’une chimiothérapie adjuvante avaient été soigneusement sélectionnées avec des variables de confusion potentiellement non prises en compte. De plus, aucun détail n’est donné quant aux régimes de chimiothérapie administrés, aux réductions de doses réalisées, aux effets indésirables et à la qualité de vie pendant et après la chimiothérapie adjuvante. Il faut donc rester prudent vis-à-vis de la balance bénéfice/risque d’une chimiothérapie adjuvante et par extension vis-à-vis du rapport quantité de vie/qualité de vie…
En parallèle, Crozier et al. (9) viennent de publier les résultats d’une analyse rétrospective appariée avec score de propension réalisée sur une cohorte de 16 062 patientes avec un cancer du sein non métastatique triple négatif (stade I-III) menant aux mêmes conclusions. Les patientes qui ont reçu une chimiothérapie ont une amélioration de la SG par rapport à celles avec indication de chimiothérapie mais ne l’ayant pas reçue (n = 1884 paires appariées), que ce soit en l’absence d’envahissement ganglionnaire (HR = 0,80 ; IC95 : 0,66-0,97 ; p = 0,007), en présence d’envahissement ganglionnaire (HR = 0,76 ; IC95 : 0,64-0,91 ; p = 0-006) ou en cas de score de comorbidité supérieur à 0 (HR = 0,74 ; IC95 : 0,59-0,94 ; p = 0-013).
Des études standardisées prospectives multidisciplinaires sont nécessaires pour confirmer ces résultats mais ces études ont le mérite d’avoir analyser une grande cohorte et de mettre en évidence le risque de sous-traitement du sujet âgé.
Références
1. Derks MGM et al. Impact of comorbidities and age on cause-specific mortality in postmenopausal patients with breast cancer. Oncologist 2019;24(7): e467-e474.
2. Santé publique France. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Volume 1 – Tumeurs solides. Juillet 2019.
3. National Comprehensive Cancer Network. Breast cancer (version 4.2020). Accessed April 1, 2020. https://www.nccn.org/professionals/physician_gls/pdf/breast_blocks.pdf.
4. Polychemotherapy for early breast cancer: an overview of the randomised trials. Early Breast Cancer Trialists’ Collaborative Group. Lancet 1998;352(9132):930-42.
5. Giordano SH et al. Use and outcomes of adjuvant chemotherapy in older women with breast cancer. J Clin Oncol 2006;24(18):2750-6.
6. Muss HB et al; Cancer and Leukemia Group B. Adjuvant chemotherapy in older and younger women with lymph node-positive breast cancer. JAMA 2005;293(9):1073-81.
7. Référentiel diagnostique et thérapeutique SEIN-REMAGUS 2019-2021.
8. Tamirisa N et al. Association of chemotherapy with survival in elderly patients with multiple comorbidities and estrogen receptor-positive, node-positive breast cancer. JAMA Oncol 2020;6(10):1548-1554.
9. Crozier JA et al. Addition of chemotherapy to local therapy in women aged 70 years or older with triple-negative breast cancer: a propensity-matched analysis. Lancet Oncol 2020 Dec;21(12):1611-9.
















