Atézolizumab + carboplatine/étoposide versus carboplatine/étoposide en 1re ligne dans les CBPC à un stade avancé : actualisation de la SG de l’étude de phase I/III IMpower 133
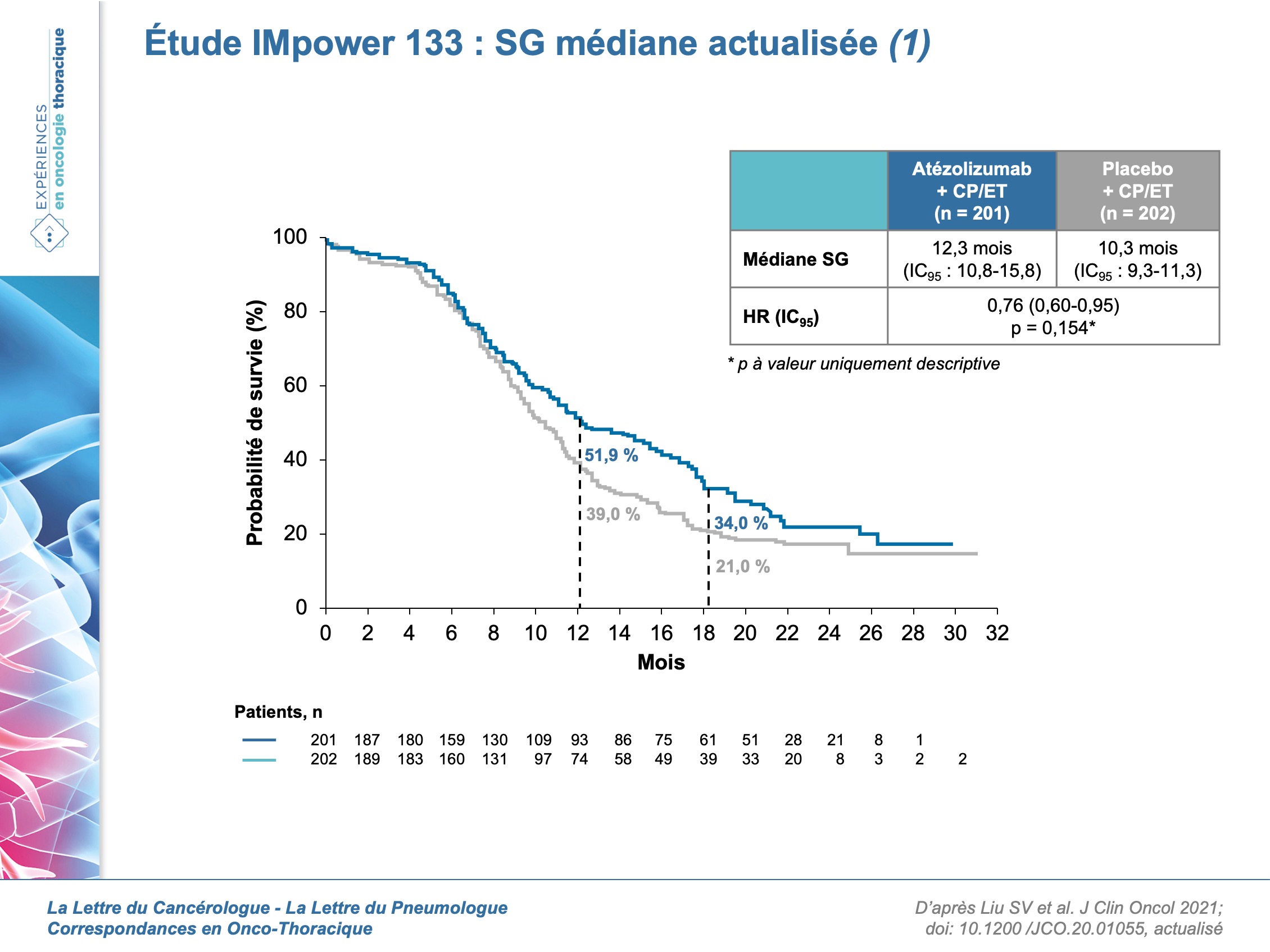
L’étude de phase I/III IMpower 133 a évalué l’efficacité et la tolérance de l’ajout d’un anti-PD-L1 – l’atézolizumab – à une chimiothérapie – CT (carboplatine/étoposide)(n= 201) versus CT seule (202) en 1re ligne de traitement d’un CBPC à un stade avancé. Les résultats de l’analyse primaire de l’étude, avec un suivi médian de 13,9 mois avaient montré un bénéfice à l’ajout d’atézolizumab en termes de SG médiane (12,3 vs 10,3 mois ; HR = 0,70 ; p = 0,007) et de SSP médiane (5,2 mois vs 4,3 mois ; HR = 0,77 ; p = 0,02). Ce sont les résultats actualisés de SG et selon le statut mutationnel qui ont été publiés en ce début d’année [1]. Le suivi comporte une période de 9 mois supplémentaire et le suivi médian est de 23,1 mois dans le bras atézolizumab et de 22,9 mois dans le bras contrôle (302 décès). L’analyse actualisée de la SG montre une SG médiane de 12,3 mois (IC95 : 10,8-15,8 mois) dans le bras atézolizumab vs 10,3 mois (IC95 : 9,3-11,3 mois) dans le bras contrôle (HR = 0,76 ; IC95 : 0,60-0,95 ; p descriptif = 0,0154) avec des taux de survie à 12 et 18 mois, respectivement de 51,9 % vs 39 % et de 34 % vs 21 % (figures).
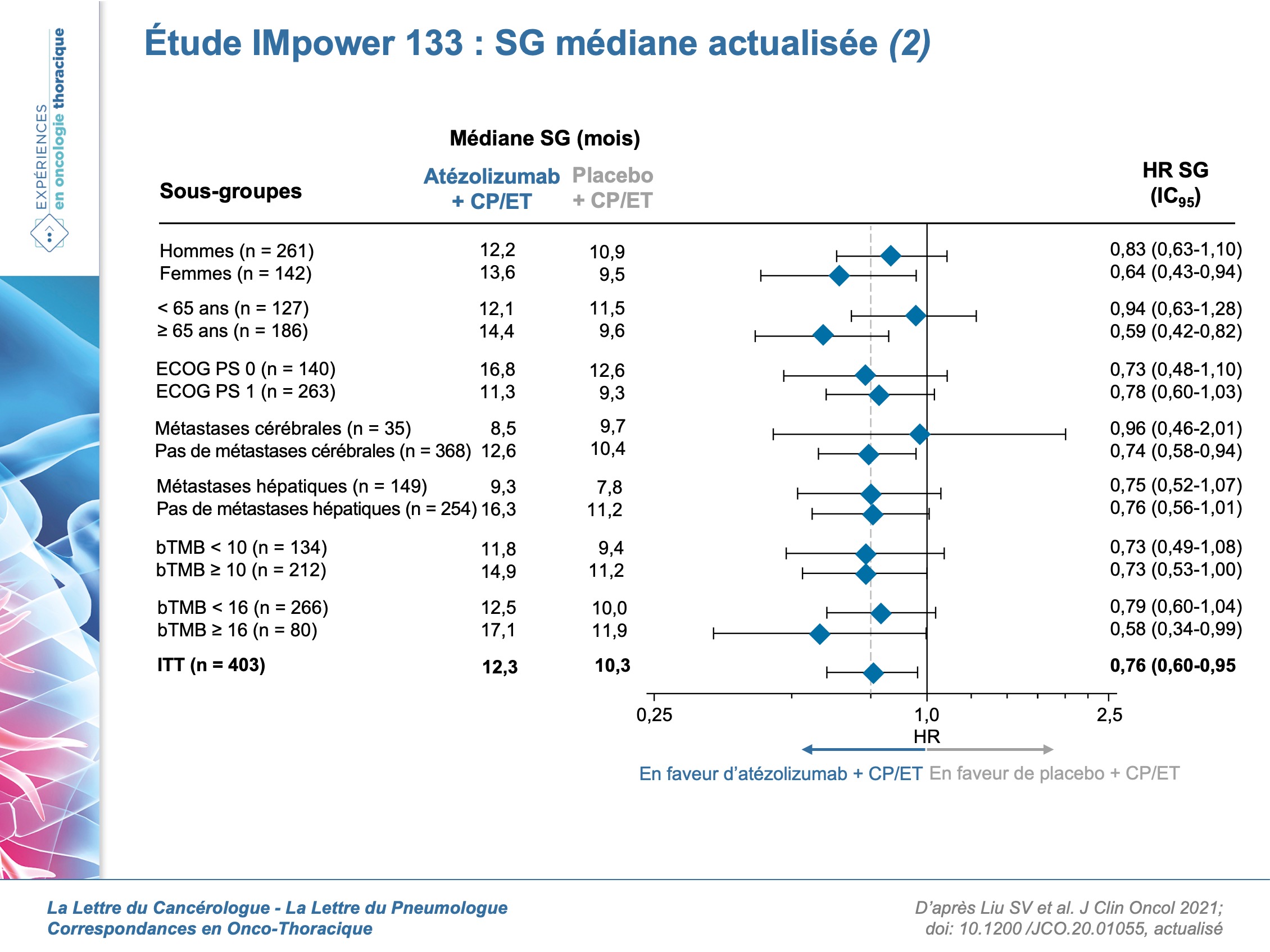
La SSP médiane actualisée est de 5,2 mois vs 4,3 mois (HR = 0,77 ; IC95 : 0,63-0,95) et l’analyse de la réponse confirme des taux de réponse objective (RO) de 60,2 % (atézolizumab) vs 64,4 % (contrôle ; p descriptif = 0,3839). La durée médiane de la réponse est de 4,2 vs 3,9 mois (HR = 0,67 ; IC95 : 0,51-0,88). Chez les 137 patients où le statut PD-L1 (non obligatoire) à l’inclusion avait été déterminé, la SG médiane chez les patients avec une expression sur les cellules tumorales/cellules infiltrant la tumeur < 1%, ≥ 1%, et ≥ 5% est, respectivement, de 10,2 vs 8,3 mois (HR = 0 ,51 ; IC95 : 0,30-0,89), 9,7 vs 10,6 mois (HR = 0,87 ; IC95 : 0,51–1,49) et 21,6 vs 9,2 mois (HR = 0,60 ; IC95 : 0,25-1,46). Pour les 346 patients avec des données disponibles sur la charge mutationnelle sanguine (bTMB), les HR s’établissent à 0,73 (IC95 : 0,49-1,08) et 0,73 (IC95 : 0,53-1,00) pour des scores < 10 et ≥ 10, et à 0,79 (IC95 : 0,60-1,04) et 0,58 (IC95 : 0,34-0,99) pour des scores < 16 et≥ 16. L’analyse de la tolérance confirme les données rapportées dans l’analyse primaire : les effets indésirables (EI) immuns ayant nécessité l’instauration d’une corticothérapie systémique ont été observés chez 20,2 % (atézolizumab) vs 5,6 % (contrôle) des patients. Les Ei immuns les plus fréquents étaient les rash (20,2 % vs 10,7 %), les hypothyroïdismes (12,6 % vs 0,5 %), les hépatites (7,6 % vs 4,6 %) et les réactions en rapport avec la perfusion (5,6 % vs 5,1 %). Les pneumonies d’origine immune ont été observées chez 2,5 % (atézolizumab) vs 2,6 % (contrôle) des patients.
Ce que cet article apporte à ma pratique :
- Le bénéfice de l’ajout d’atézolizumab au carboplatine/étoposide en 1re ligne de traitement dans les CBPC à un stade avancé sur la SG est confirmé ;
- Un nouveau standard de traitement avec un profil de tolérance acceptable ;
- Un bénéfice nettement plus important sur la SG chez les patients avec une expression PD-L1 ≥ 5 % (21,6 vs 9,2 mois).
Références
1. Liu SV et al. Updated overall survival and PD-L1 subgroup analysis of patients with extensive-stage small-cell lung cancer treated with atezolizumab, carboplatin, and etoposide (IMpower133). J Clin Oncol 2021; DOI https://doi. org/10.1200 /JCO.20.01055.
















