CheckMate-9LA : si on réduisait les cycles de chimiothérapie ?
Récemment, l’immunothérapie par anti-PD-(L)1, ou en combinaison avec un anti-CTLA-4, s’est imposée comme traitement standard en première ligne dans le CBNPC. Cependant, il existait des hyperprogressions dans les premières semaines de traitement, motivant l’adjonction d’une chimiothérapie à l’immunothérapie qui apportait aussi son lot d’effets indésirables. L’hypothèse à l’origine de cette étude [1] est que réduire de 4 à 2 cycles la durée de chimiothérapie permettrait de diminuer les effets secondaires tout en gardant le bénéfice attendu.
Pour être inclus les patients devaient être agés de plus de 18 ans, avoir un PS ≤ 1 et ne devaient pas avoir reçu de traitement systémique pour ce cancer métastatique (ils pouvaient avoir été traités antérieurement pour ce cancer par chimiothérapie périopératoire ou radiochimiothérapie à condition que ces traitements aient été interrompus il y a plus de 6 mois). L’inclusion de patients présentant des métastases cérébrales antérieurement traitées et non évolutives était autorisée à condition que ces malades ne reçoivent pas plus de 10 mg de prednisone ou équivalent. Ils ne devaient pas présenter de mutation de l'EGFR ni de translocation ALK-EML4 (ou même de statut indéterminé s’ils avaient un cancer non épidermoïde). Ils ne devaient pas avoir de maladie auto-immune, de méningite carcinomateuse, de pneumopathie interstitielle diffuse, d’antécédents HIV ou cancéreux.
Dans cette étude de phase III internationale randomisée menée d’août 2017 à janvier 2019, les patients étaient randomisés en 1:1 avec une stratification sur l’histologie, le sexe et le statut PD-L1 (< 1 % et ≥ 1 %) selon ce schéma :
Groupe chimiothérapie seule :
- Épidermoïdes : 4 cycles de carboplatine (ASC 6) et paclitaxel (200 mg/m2) ;
- Non-épidermoïdes : 4 cycles de carboplatine (ASC 5-6) ou cisplatine (75 mg/m2) et pémétrexed (500 mg/m2) qui pouvait être poursuivi en maintenance dans ce bras.
Groupe combo-thérapie :
- Deux cycles de la même chimiothérapie selon l’histologie (pas de maintenance par pémétrexed autorisée) ;
- Associée à une immunothérapie jusqu’à progression, toxicité ou 2 ans (nivolumab (360 mg) toutes les 3 semaines et ipilimumab (1 mg/kg) toutes les 6 semaines.
- Le crossover n’était pas autorisé entre les 2 groupes, mais les patients pouvaient recevoir une immunothérapie de 2e ligne.
Le critère de jugement principal était la SG, tandis que les secondaires étaient la SSP et le taux de réponse objective.
Au total, 719 patients ont été inclus dont 361 assignés au groupe combo-thérapie et 358 au groupe chimiothérapie. Les caractéristiques étaient bien réparties avec 70 % d’hommes d’un âge médian de 65 ans (environ 10 % > 75 ans) majoritairement fumeurs ou ancien fumeurs. 30 % avait une histologie épidermoïde, 18 et 16 % avaient une atteinte cérébrale et 19-24 % une atteinte hépatique. 60 % des tumeurs exprimées PD-L1 ≥ 1 %.
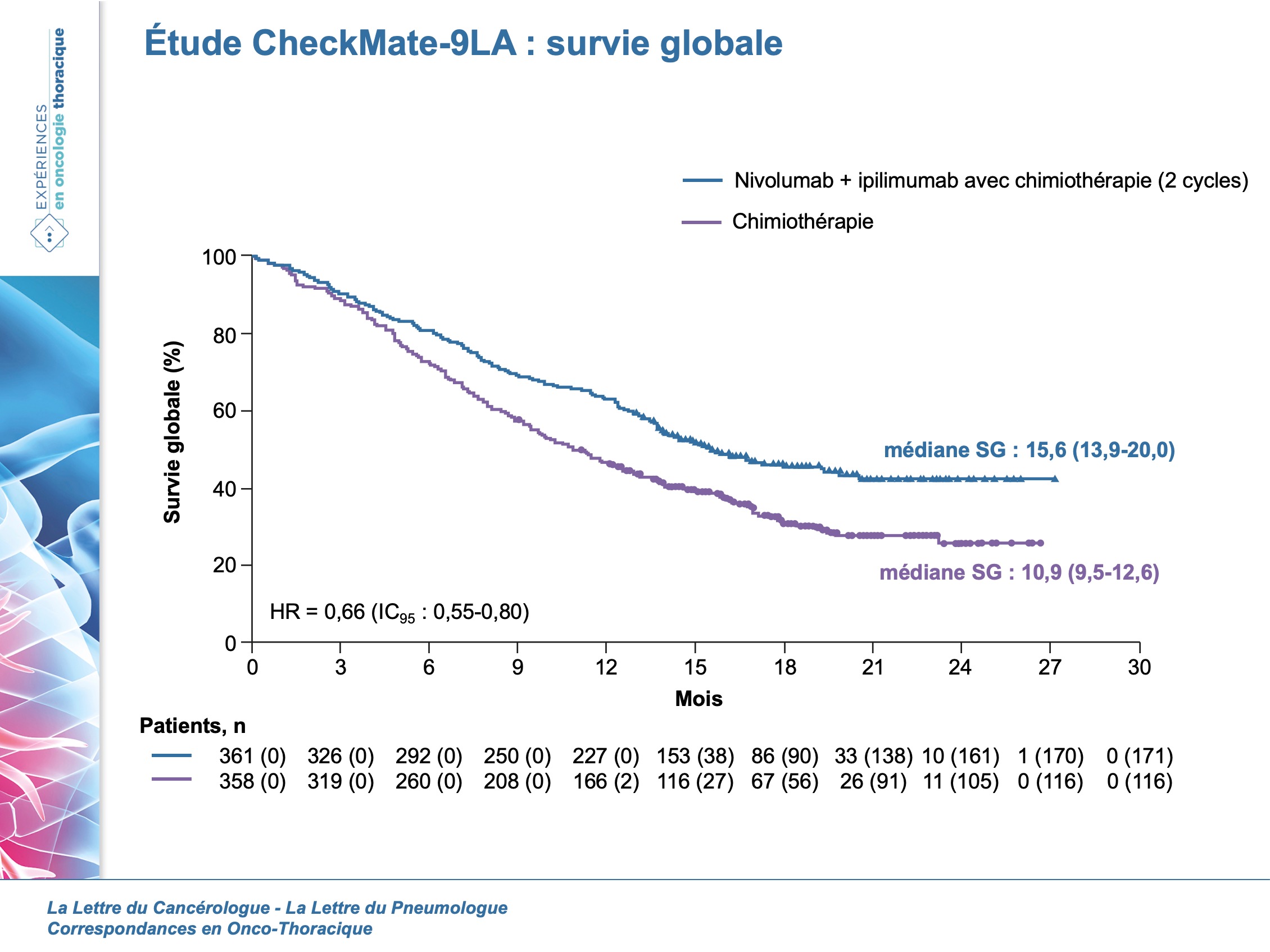
Le comité d’analyse indépendant a validé, lors de l’analyse intérimaire prévue, que l’étude CheckMate-9LA avait atteint son objectif primaire. Ainsi, la médiane de SG était de 14,1 mois (IC95 : 13,2-16,2] et 10,7 mois (IC95 : 9,5-12,4) pour le groupe combothérapie et chimiothérapie respectivement (HR = 0,69 ; IC96,71 : 0,55-0,87 ; p = 0,000065). La médiane de SSP était de 6,8 mois (IC95 : 5,6-7,7) versus 5 mois (IC95 : 4,3-5,6) (HR = 0,7 ; IC97,48 : 0,57-0,86) et le taux de réponse objective était de 37,7 % (IC95 : 32,7-42,9) versus 25,1 % (IC95 : 20,7-30), respectivement.
Avec un suivi additionnel de 4,6 mois, la médiane de SG augmente pour le groupe combothérapie à 15,6 mois (IC95 : 13,9-20) versus 10,9 mois (IC95 : 9,5-12,6) avec un HR à 0,66 (IC95 : 0,55-0,8) (figure). Le taux de survie à 12 mois était de 63 % versus 47 %, respectivement. La combothérapie était supérieure mieux dans tous les sous-groupes (même PD-L1 négatif) à l’exception des patients âgés de plus de 75 ans, probablement en lien avec un manque de puissance sur l’effectif réduit.
Après progression, 31 % des patients du groupe combothérapie et 53 % du groupe chimiothérapie reçoivent un traitement de 2e ligne. Ce traitement était dans 5 % et 30 % des cas une immunothérapie, respectivement.
Concernant la tolérance, des effets secondaires de grade 3-4 ont été rapportés chez 47 % des patients du groupe combothérapie et 38 % du groupe chimiothérapie, parmi lesquels la neutropénie, l’anémie et les diarrhées étaient les plus fréquents. Des effets secondaires sévères de tous grades sont survenus chez 30 et 18 % des patients respectivement, qui étaient principalement des diarrhées, neutropénies fébriles, anémies et thrombopénies. Le traitement a été interrompu dans 19 versus 7 % des cas respectivement, à cause d’effets indésirables. À noter que 7 et 6 patients sont décédés dans chaque groupe respectivement en lien avec le traitement.
Ce que cet article apporte à ma pratique :
- Une double immunothérapie associée à 2 cycles de chimiothérapie permet d’obtenir une meilleure survie qu’une chimiothérapie seule.
- Cette courte chimiothérapie permet d’éviter les cas d’hyperprogression que l’on voit sous immunothérapie seule, devant la disparition du croisement des courbes dans leur partie initiale.
- En septembre 2020, l’Agence européenne des médicaments a rendu un avis favorable pour ce traitement en 1re ligne chez les CBNPC métastatiques non mutés EGFR ou transloqués ALK.
- Même si on ne peut pas comparer les essais entre eux, réduire la chimiothérapie à 2 cycles ne semblent pas impacter la SG des patients en comparaison aux essais KEYNOTE-407 (épidermoïde) et -021 (non épidermoïde) [2-3].
Références
1. Paz-Ares L et al. First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in patients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial. Lancet Oncol 2021 Feb;22(2):198-211. doi: 10.1016/S1470-2045(20)30641-0.
2. Paz-Ares L et al. A randomized, placebo-controlled trial of pembrolizumab plus chemotherapy in patients with metastatic squamous NSCLC: protocol-specified final analysis of KEYNOTE-407. J Thorac Oncol 2020;15:1657-69.
3. Awad MM et al. Long-term overall survival from KEYNOTE-021 cohort G: pemetrexed and carboplatin with or without pembrolizumab as first-line therapy for advanced nonsquamous NSCLC. J Thorac Oncol 2021;16:162-8.
















