Efficacité du capmatinib dans le CBNPC avec altération de MET
Les mutations du site d’épissage avec saut de l’exon 14 (mut ex14) de cMET sont présentes chez environ 3 à 4 % des patients atteints de cancer bronchique non à petites cellules (CBNPC), alors que l’amplification (amp) de cMET est présente chez 1 à 6 % d’entre eux. Récemment, ces altérations moléculaires sont apparues comme de potentiels biomarqueurs prédictifs de réponse aux thérapies ciblées dirigées sur le gène MET.
Le capmatinib, un inhibiteur très puissant et sélectif, a montré une activité in vitro et in vivo dans des modèles de cancer avec différents types d’activation du gène MET. En plus, le capmatinib diffuse bien au travers de la barrière hémato-encéphalique.
L’étude GEOMETRY mono-1 [1] est un essai de phase II, évaluant l’activité du capmatinib chez des patients atteints d’un CBNPC de stade avancé (stade IIIB-IV) avec une mut ex14 ou amp de cMET. Les patients avec métastases cérébrales stables sans augmentation de la dose de glucocorticoïdes dans les 2 semaines précédant l’inclusion étaient éligibles.
Les patients ont été répartis en 5 cohortes selon le statut cMET et les lignes de traitement antérieurs pour l’évaluation de l’efficacité sur la base d’hypothèses statistiques prédéfinies (figure 1).
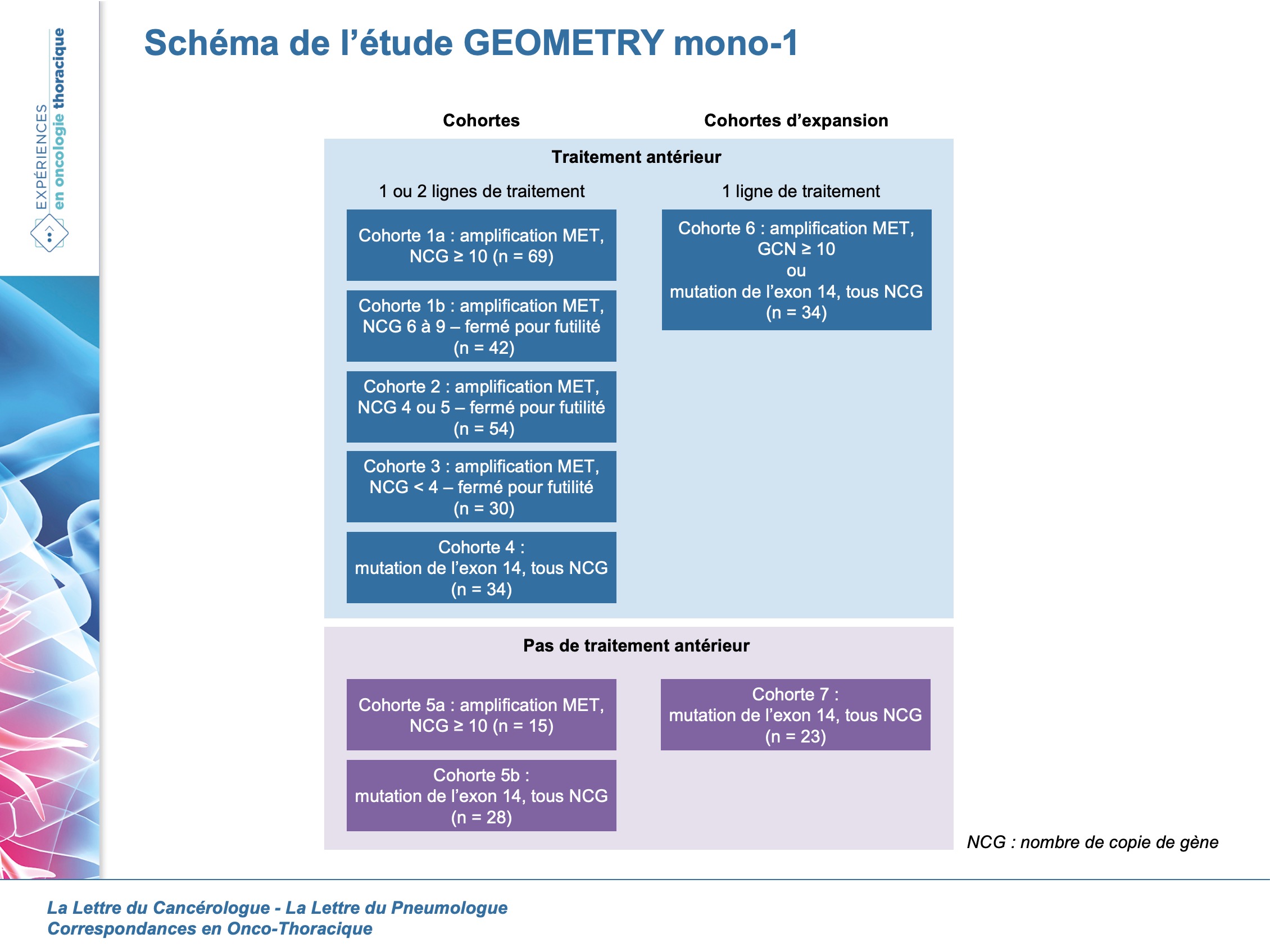
L’objectif principal était la réponse globale. Les critères d’évaluation secondaires étaient la durée de la réponse, la réponse évaluée par l’investigateur et sa durée, la survie sans progression, ainsi que le profil de tolérance et la pharmacocinétique.
Au total, 364 patients ont été inclus. L’âge médian des patients était légèrement plus élevé dans les cohortes avec des patients présentant une mut ex14 (71 ans) versus amp de cMET (60 à 70 ans). Les patients présentant une mut ex14 de cMET étaient plus souvent des femmes et sans exposition au tabac par rapport aux patients avec amp de cMET.
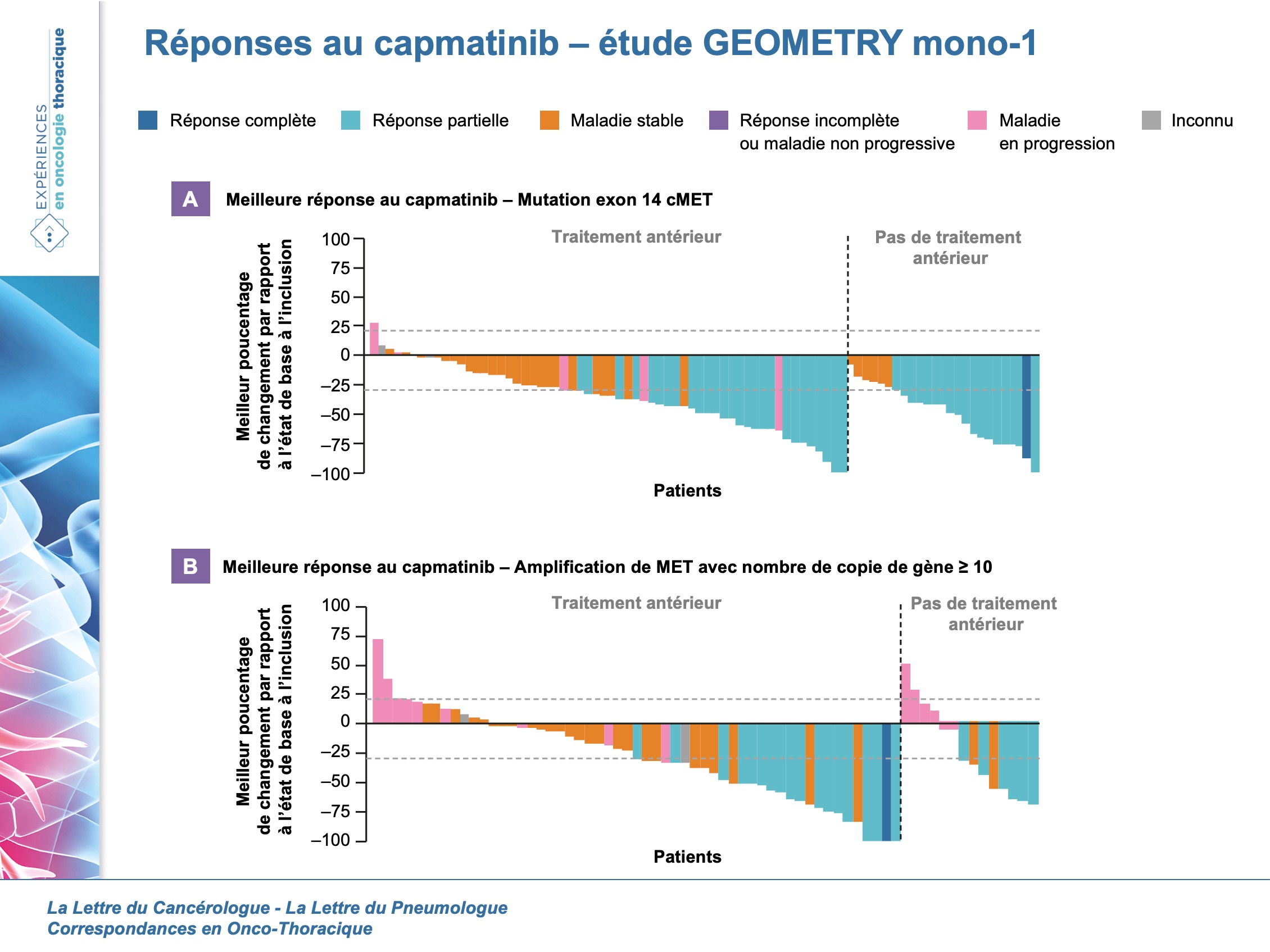
Parmi les patients avec mut ex14, il était retrouvé une réponse globale chez 41 % (IC95 : 29-53) des 69 patients précédemment traités et chez 68 % (IC95 : 48-84) des 28 patients qui n’avaient pas reçu de traitement auparavant (figure 2). La durée médiane de réponse était de 9,7 mois (IC95 : 5,6-13,0) chez les patients précédemment traités et de 12,6 mois (IC95 : 5,6-NR) chez les patients qui n’avaient pas reçu de traitement auparavant.
La survie médiane sans progression était de 5,4 mois (IC95 : 4,2-7,0) chez les patients précédemment traités et de 12,4 mois (IC95 : 8.2-NR) chez les patients qui n’avaient pas reçu de traitement auparavant. 12 des 13 patients avec métastases cérébrales ont montré un contrôle cérébral de la maladie.
Une efficacité limitée a été observée chez des patients précédemment traités avec une amp de cMET et nombre de copies de gènes < 10. Parmi les patients avec une amp de cMET et un nombre de copies de gènes ≥ 10, une réponse globale a été observée chez 29 % (IC95 : 19-41) des patients précédemment traités et chez 40 % (IC95 : 16-68) de ceux qui n’avaient pas reçu de traitement auparavant (figure 2).
Pour l’ensemble des cohortes (364 patients), les effets indésirables les plus fréquemment rapportés étaient les œdèmes périphériques (52 %), les nausées (44 %) et les vomissements (28 %), surtout de grade 1 ou 2 survenant chez 51 % des patients.
L’arrêt définitif du traitement a été rapporté chez 39 patients (16 %) avec un décès par pneumonie potentiellement lié au capmatinib.
Le capmatinib a montré une activité antitumorale intéressante chez les patients atteints de CBNPC de stade avancé avec une mut ex14 de cMET, en particulier non prétraités. L’efficacité sur l’amp de cMET était corrélée au nombre de copies de gènes (≥ 10).
Le capmatinib est actuellement accessible dans le cadre d’une ATU nominative en France après échec d’une première ligne de traitement. Ces résultats sont similaires à ceux d’un autre inhibiteur de cMET, le tépotinib, qui a montré une réponse partielle chez environ 50 % des patients présentant une mut ex14 de cMET (2).
Ce que cet article apporte à ma pratique :
- Le capmatinib, un inhibiteur sélectif du récepteur du gène MET, a montré une activité dans des modèles de cancer avec différents types d’activation de cMET.
- Les auteurs ont évalué l’efficacité du capmatinib chez des patients avec une mutation du site d’épissage avec saut de l’exon 14 de cMET ou une amplification de cMET.
- Parmi les patients atteints de CBNPC avec une mut ex14, une réponse globale a été observée chez 41% des patients qui avaient reçu une ou deux lignes de traitement et chez 68 % qui n’avaient pas reçu de traitement
- Parmi les patients ayant une amp de cMET et un nombre de copies de gènes ≥ 10, une réponse globale a été observée chez 29 % des patients précédemment traités et chez 40 % de ceux qui n’avaient pas reçu de traitement auparavant.
- Les effets indésirables les plus fréquemment signalés étaient les œdèmes périphériques (52 %) et les nausées (44 %), pour la plupart de grade 1 ou 2.
Conclusion
Cette étude confirme l’efficacité du capmatinib pour les patients avec une mutation du site d’épissage avec saut de l’exon 14 de MET ou une amplification de cMET avec un nombre de copie ≥ 10.
Capmatinib : une option thérapeutique supplémentaire pour les patients avec une altération du gène MET.
Références
1. J. Wolf et al. Capmatinib in MET Exon 14–Mutated or MET-Amplified Non–Small-Cell Lung Cancer. N Engl J Med. 2020 Sep 3;383(10):944-57.
2. Paik PK et al. Tepotinib in Non–Small-Cell Lung Cancer with MET Exon 14 Skipping Mutations. N Engl J Med 2020;383:931-43.
















