Efficacité du crizotinib dans les cancers broncho-pulmonaire ayant une mutation de l’exon 14 de MET
Les altérations de l’exon 14 de MET sont présentes dans 3 à 4 % des cancers broncho-pulmonaires non à petites cellules (CBNPC). Celles-ci, par un défaut de dégradation du recepteur de MET, favorisent l’activation des voies de signalisations menant à l’oncogénèse. Le crizotinib est un inhibiteur multi-tyrosine kinase approuvé pour le traitement des CBNPC présentant un réarrangement ALK ou ROS1. Cette étude prospective (1), qui est une expansion de cohorte de PROFILE 1001, a pour but de démontrer l’efficacité du crizotinib chez les CBNPC ayant une mutation de l’exon 14 de MET.
L’objectif principal était le taux de réponse objective sous crizotinib. Les objectifs secondaires étaient la durée médiane de traitement, les survies sans progression et globale et la toxicité. Les patients recevaient du crizotinib 250 mg 2 fois par jour. Les altérations de l’exon 14 de MET ont été identifiées par un séquençage haut-débit de l’ADN ou de l’ARN dans un prélèvement tissulaire ou sanguin. Le suivi était réalisé par scanner toutes les 8 semaines.
Entre le 11 septembre 2014 et le 26 janvier 2018, 69 patients ont été inclus et ont reçu du crizotinib. L’âge médian était de 72 ans et 61 % des patients étaient des anciens fumeurs. La plupart des patients présentaient un adénocarcinome (84 %) et 62 % avaient reçu une première ligne de chimiothérapie.
Concernant le traitement par crizotinib (figures 1 et 2) :
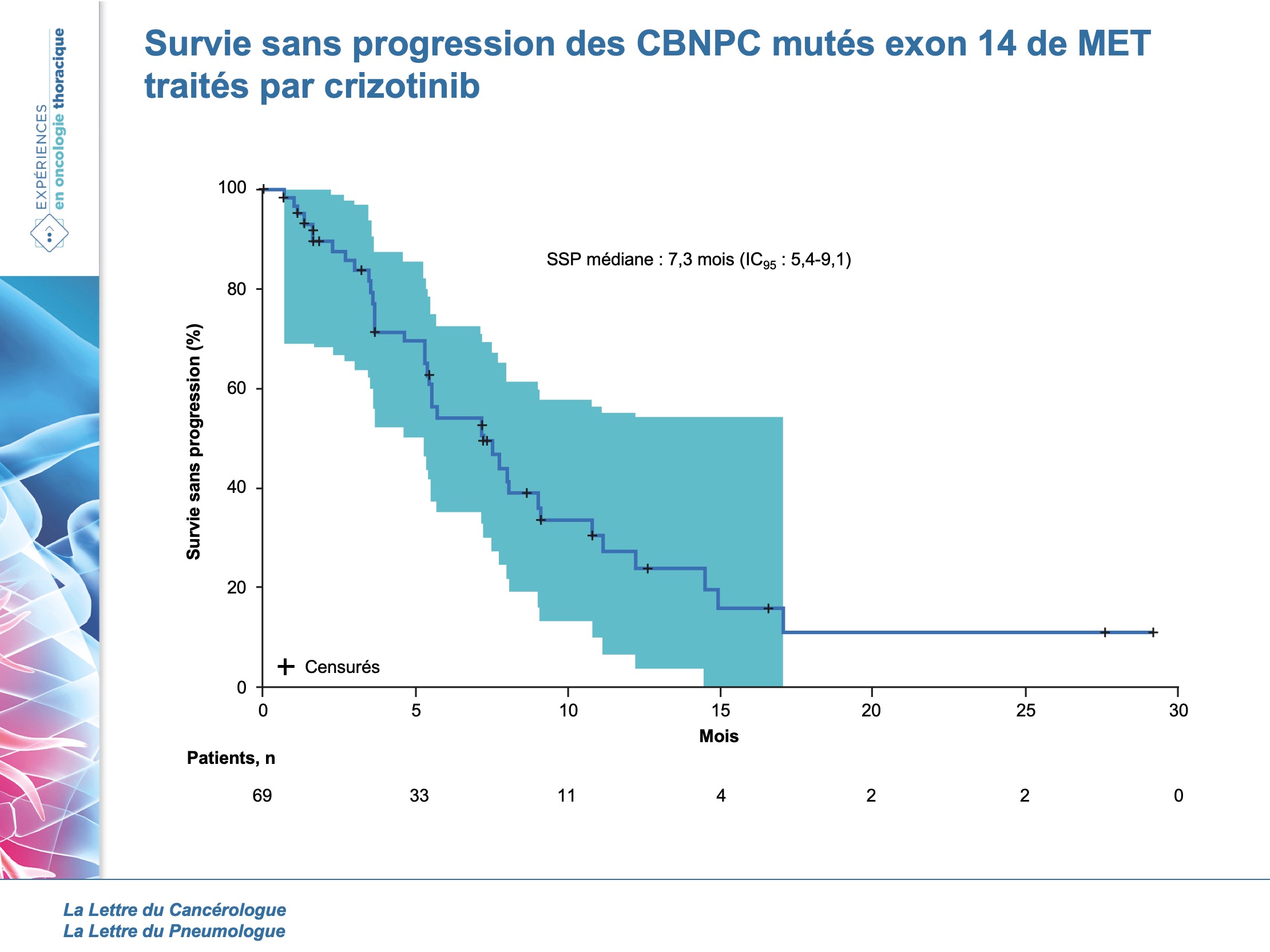
La durée médiane de traitement était de 7,4 mois (5,5-9,1) et 20 patients recevaient encore le traitement à la date de cut-off. Le taux de réponse objective était de 32 % (21-45) avec 5 % de réponse complète, 28 % de réponse partielle et 45 % de stabilité. La durée médiane de réponse était de 9,1 mois (6,4- 12,7). Sur les 21 patients ayant une réponse objective, 57 % ont une réponse ≥ 6 mois. La médiane de survie sans progression était de 7,3 mois (5,4-9,1) et la médiane de survie globale de 20,5 mois (14,3-21,8). La probabilité de survie à 6 et à 12 mois était de 87 % (74,7-93,1) et 70 % (54,7-81,1), respectivement.
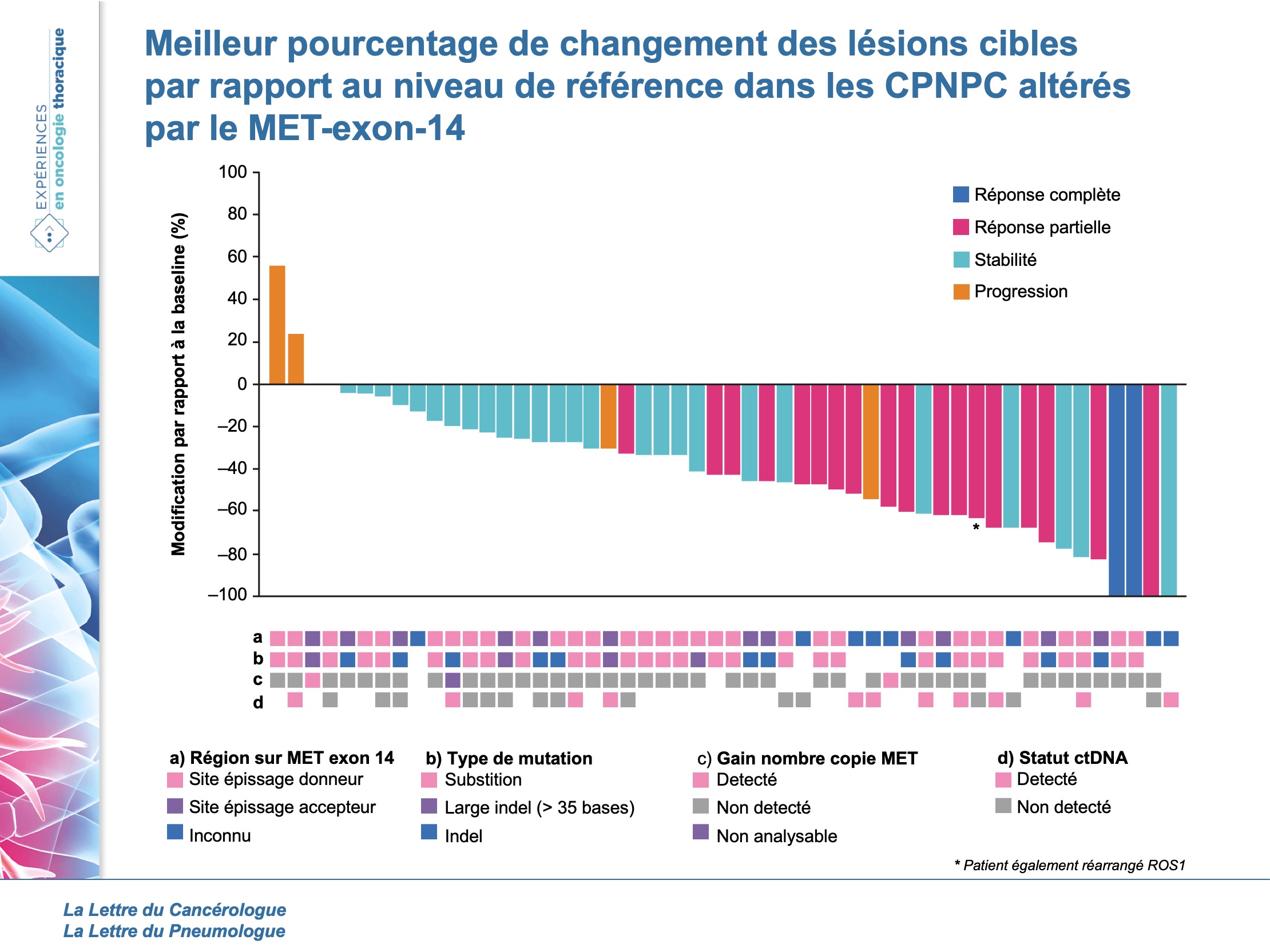
Concernant les altérations :
Les mutations survenait dans 57 % sur le site d’épissage donneur (soit en 3’ de l’intro 13) et dans 25 % sur le site d’épissage accepteur (soit en 5’ de l’intron 14). Le type de mutation le plus fréquent était les substitutions (51 %). Il n’y avait aucune différence significative sur le taux de réponse objective selon l’endroit des mutations ou leur type. Deux patients avaient une amplification concomittante modérée du gène MET et présentaient un contrôle de la maladie > 6 mois.
Concernant le type de prélèvement :
Parmi les 37 patients avec une mutation de l’exon 14 de MET identifiée sur tissu et ayant des échantillons de sang analysables, 18 (49 %) avaient une mutation detectée dans l’ADN tumoral circulant (ctDNA-positif). Il n’y avait aucune différence significative sur le taux de réponse objective entre les ctDNA-positif et les ctDNA-négatif (19 vs 24 %, respectivement). Cependant, la survie sans progression était significativement plus courte dans le groupe ctDNA-positif par rapport au ctDNA-négatif avec une médiane de 3,7 mois (1,6-7,2) versus 8,1 mois (7,3-non estimable ; HR = 3,85 ; p = 0,01), respectivement.
Il faut faire attention à l’échantillon faible de cette population ctDNA et à l’interprétabilité des résultats. Aucune conclusion ne peut être tirée actuellement.
Concernant la toxicité :
Le profil de toxicité était similaire à celui rapporté dans les études des CBNPC réarrangés ALK ou ROS1. Tous grades confondus, les plus communs étaient : œdeme (51 %) ; trouble visuel (45 %) ; nausée (41 %) ; diarrhée (39 %). Concernant les grades 3, les plus fréquents étaient : cytolyse (4 %) et dyspnée (4 %). Il n’y a eu que trois grades 4 : hypophosphatémie, lymphopénie et embolie pulmonaire et un grade 5 : pneumopathie interstielle. Ces effets secondaires ont conduit à une réduction de dose ou un arrêt permanent dans 38 et 7 % des cas, respectivement.
Ce que cet article apporte à ma pratique :
- Les CBNPC ayant une altération de MET se retrouvent plutôt chez des patients de plus de 60 ans et anciens fumeurs.
- Il est important de rechercher la mutation de l’exon 14 de MET en présence d’un adénocarcinome pulmonaire sans autre driver oncogénique.
- Le crizotinib peut être un traitement efficace des CBNPC mutés exon 14 de MET, avec un bon profil de toxicité.
- Aucune conclusion sur la population ctDNA ne peut être formulée devant un nombre très faible de patients.
À retenir : L'utilisation du crizotinib pour les CBNPC mutés exon 14 de MET est une thérapeutique potentielle efficace et approuvée par la FDA aux États-Unis.
















