Ibalizumab : une étude de phase III chez les patients porteurs de virus multi-résistants
Contrairement aux autres agents antirétroviraux, l’ibalizumab – anticorps monoclonal humanisé IgG4 – se fixe de façon non compétitive au domaine extracellulaire secondaire du récepteur des cellules CD4+ T, en restant à l’écart des récepteurs du complexe majeur d’histocompatibilité de classe II. Potentiellement, il prévient l’infection des cellules immunitaires CD4+ T par le VIH, tout en conservant les fonctions immunologiques normales. Après des résultats positifs en phase I et II, il a été testé dans une étude de phase III à un seul bras menée en ouvert chez 40 patients adultes infectés par un VIH multi-résistant, en échec (CV > 1 000 copies/ml) de plusieurs lignes de traitement (au moins une molécule des 3 classes). Après une période de contrôle de 7 jours où les patients continuaient à recevoir leur traitement antirétroviral habituel, une dose de charge de 2 000 mg en i.v. d’ibalizumab leur était administrée, avec mesure de la CV 7 jours plus tard. Jusqu’à la 25e semaine de l’étude, les patients ont ensuite reçu 800 mg d’ibalizumab tous les 14 jours en association avec un traitement antirétroviral optimisé comportant au moins un agent pleinement actif (figure 1).

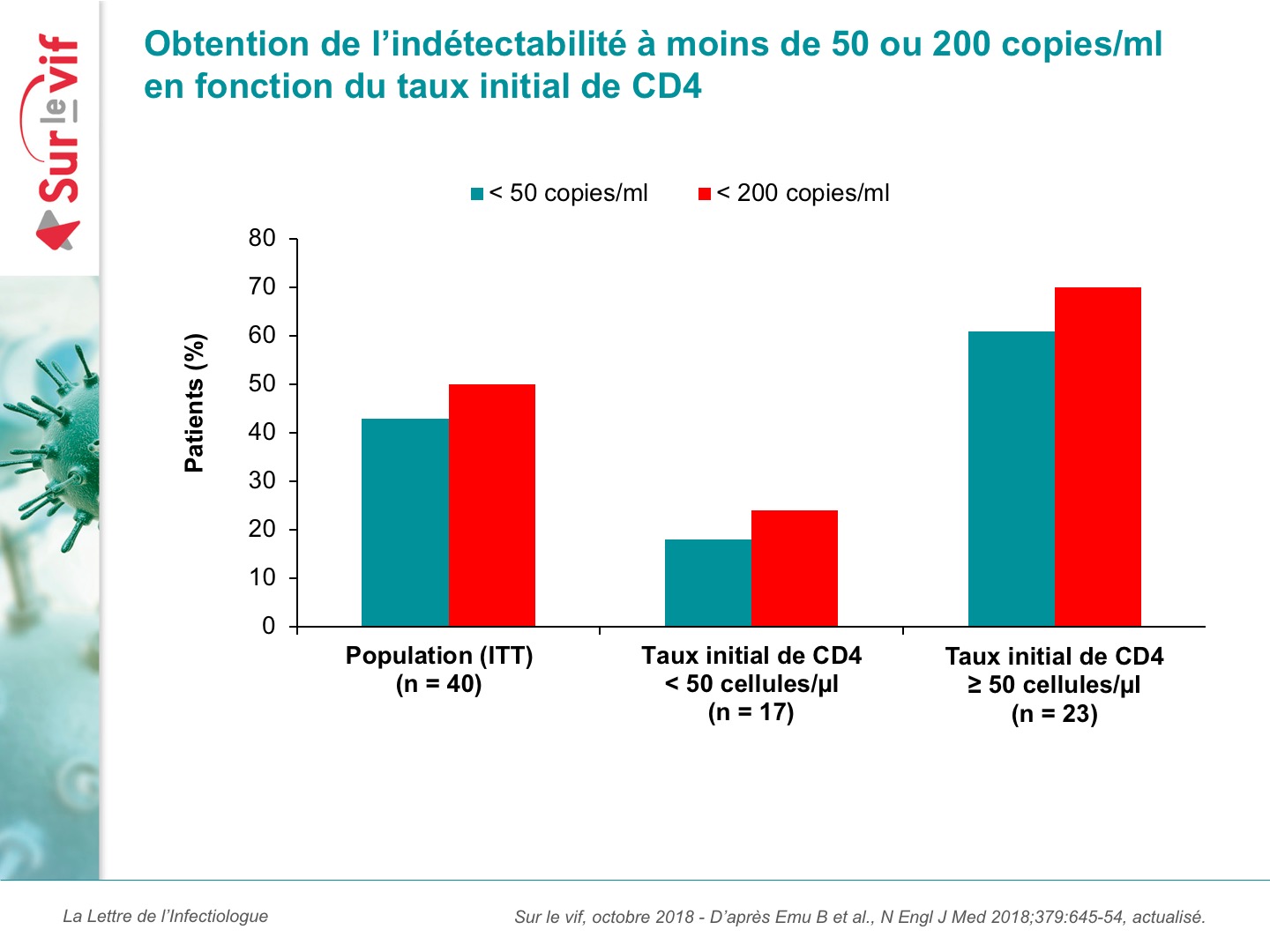
Le critère principal d’évaluation de l’étude était le pourcentage de patients avec une diminution de la CV d’au moins 0,5 log10 copies/ml entre l’inclusion (J7) et J14. Au total, 31 patients ont complété la période d’étude : les valeurs moyennes à l’inclusion étaient de 4,5 log10 copies/ml pour la CV et de 150 cellules/mm3 pour les CD4. En moyenne, ils avaient reçu 11 antirétroviraux. Sur les 40 patients en ITT, 33 (83 %) ont présenté une diminution de la CV d’au moins 0,5 log10 copies/ml entre J7 et J14 (p < 0,001 versus la période de contrôle). La diminution moyenne de la CV était de 1,1 log10 copies/ml. Au cours de la période de contrôle, seul 1 patient qui avait reçu le traitement antirétroviral optimisé de façon prématurée a présenté une diminution de la CV de 0,5 log10 copies/ml. À S25, la diminution moyenne de la CV est de 1,6 log10 copies/ml depuis les valeurs à l’inclusion chez les patients ayant reçu l’ibalizumab et le traitement optimisé : 43 % présentent une CV inférieure à 50 copies/ml et 50 % une CV inférieure à 200 copies/ml. La réponse est meilleure chez les patients avec un taux initial de CD4 > 50 cellules/mm3 (figure 2).
Pour les 10 patients ayant présenté un échec virologique ou un rebond, une sensibilité diminuée à l’ibalizumab a été mise en évidence in vitro chez 9 d’entre-eux. Enfin, la tolérance a été considérée comme satisfaisante, les effets indésirables les plus fréquents étant représentés par les diarrhées (20 % des patients). Quatre patients sont décédés et 1 patient a présenté un effet indésirable sévère (IRIS) considéré comme imputable au traitement par ibalizumab. Au total, cette étude de phase III réalisée chez des patients porteurs d’un virus multirésistant et à un stade avancé de la maladie, avec un nombre limité d’options thérapeutiques, est en faveur de l’efficacité de l’imalizumab. Une diminution de la sensibilité à ce traitement a cependant été observée in vitro chez près d’un quart des patients inclus et n’ayant pas répondu au traitement.








