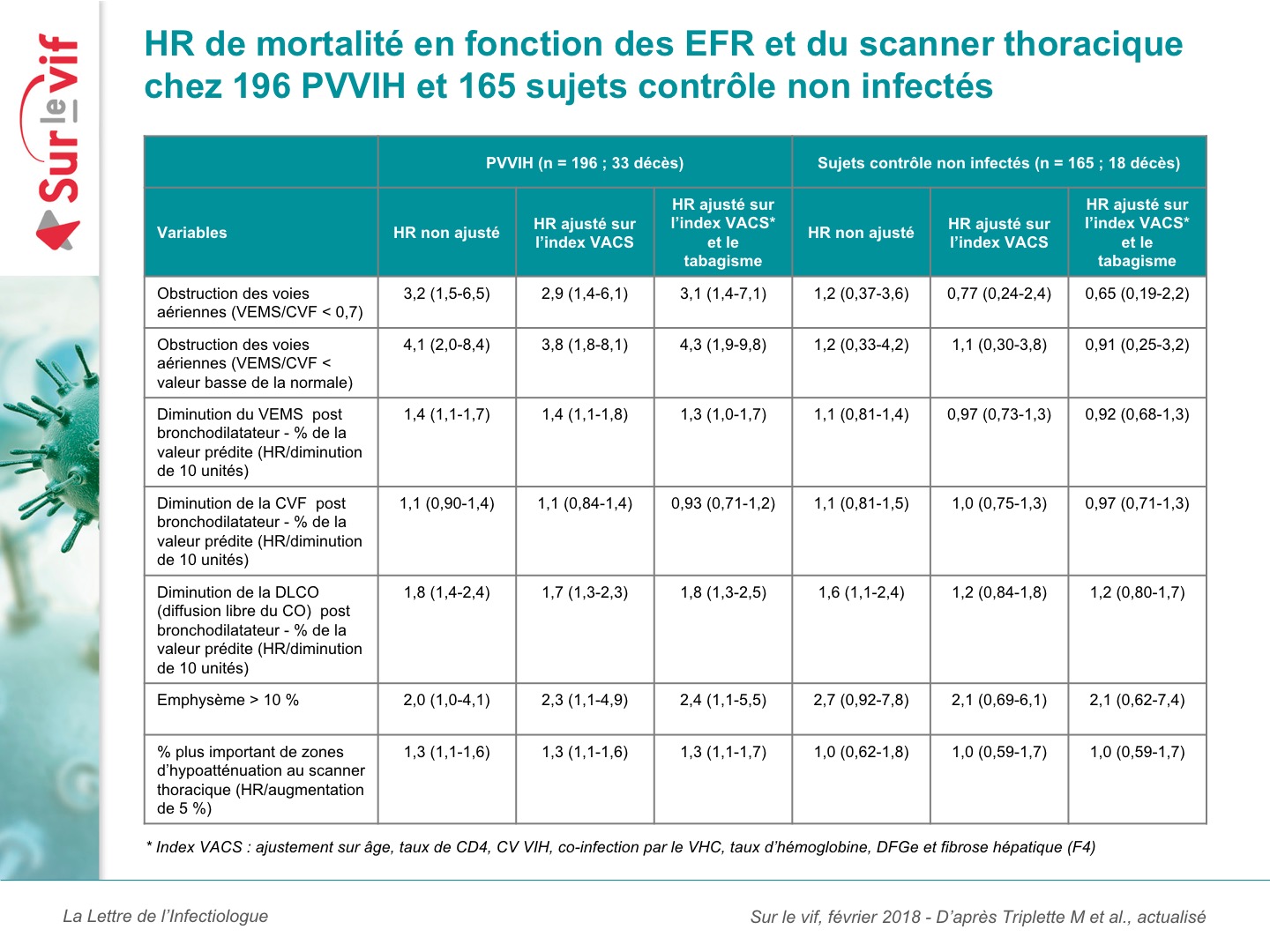
La théorie des réactions latérales en chaîne “revisitée” : l’exemple du paludisme
La théorie des chaînes latérales décrite par Paul Erlich en 1892 suppose que les anticorps reconnaissent spécifiquement les antigènes grâce à des récepteurs fixés à la molécule centrale.
Les antigènes de Plasmodium falciparum exprimés à la surface des érythrocytes infectés sont la cible de l’immunité acquise contre le paludisme. L’étude de sujets vivant en zone endémique révèle que 10 % d’entre eux ont un clone lymphocytaire B spécifique “mutant” qui produit des anticorps contenant LAIR1 (Leukocyte Associated Immunoglobulin-like Receptor 1) conduisant à une réponse immune spécifique et efficace contre le pathogène. LAIR1 est un récepteur inhibiteur du collagène codé par le chromosome 19. Lorsqu’il est muté, il est capable de reconnaître les antigènes de P. falciparum et d’entraîner l’opsonisation des érythrocytes infectés (1, 2).
L’insertion de LAIR1 dans le génome de l’anticorps peut se faire selon 2 modalités : l’exon de LAIR1 entouré de ses introns est placé soit entre les segments V et DJ, soit entre le segment constant et le segment variable de la chaîne lourde de l’immunoglobuline (figure).
Ces 2 modes d’insertion engendrent la production d’anticorps contenant un domaine additionnel avec LAIR1 soit au niveau de la boucle CDR3, soit dans la zone de switch, respectivement. Ces insertions seront la cible de mutations somatiques qui limiteront la liaison de LAIR1 au collagène et augmenteront son affinité pour les érythrocytes infectés afin de contrôler l’infection. Lorsque LAIR1 n’est pas muté, son affinité pour les parasites reste faible.
Au total, ces données illustrent un nouveau mécanisme de diversification des anticorps, via la transposition interchromosomique d’ADN, qui ouvre des possibilités de vaccination et de traitement efficaces contre les infections.









