Régorafénib-avélumab : un espoir dans le CCR métastatique MSS ? Résultats de la cohorte CCR de l’étude française REGOMUNE
La prise en charge thérapeutique des CCR métastatiques (CCRm) MSI/dMMR a été transformée par le développement des inhibiteurs de points de contrôle immunitaires, avec des taux de réponse objective (RO) de l’ordre de 30-60 % pour les anticorps anti-PD-1 (programmed cell death 1) ± anti CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) et des taux de survie globale (SG) à 1 an avoisinant 70 à 85 % en 2e ligne de traitement ou plus (Le DT et al. J Clin Oncol 2020 ; Overman MJ et al. J Clin Oncol 2018). Pour les patients MSS/pMMR, leur association au régorafénib, inhibiteur de tyrosine kinase multicible à composante antiangiogénique est susceptible d’avoir un effet synergique par la diminution de l’infiltration des macrophages et l’inhibition de la prolifération des lymphocytes T régulateurs (TREG) qu’elle génère (Hoff S et al. Ann Oncol 2017). Des premiers résultats prometteurs d’association régorafénib + nivolumab (étude de phase Ib REGONIVO) ont été rapportés avec des taux de RO de 36 % et une médiane de SG de 7,9 mois chez des patients avec CCRm lourdement prétraités (Fukuoka S et al. J Clin Oncol 2020).
L’objectif de l’étude REGOMUNE était d’évaluer l’intérêt d’une association régorafénib + avélumab, anticorps anti-PD-L1 chez des patients avec CCRm MSS prétraités par une ligne thérapeutique ou plus (figure 1). Il s’agissait d’une phase II monobras multicentrique et le critère de jugement principal était le taux de RO à 6 mois.
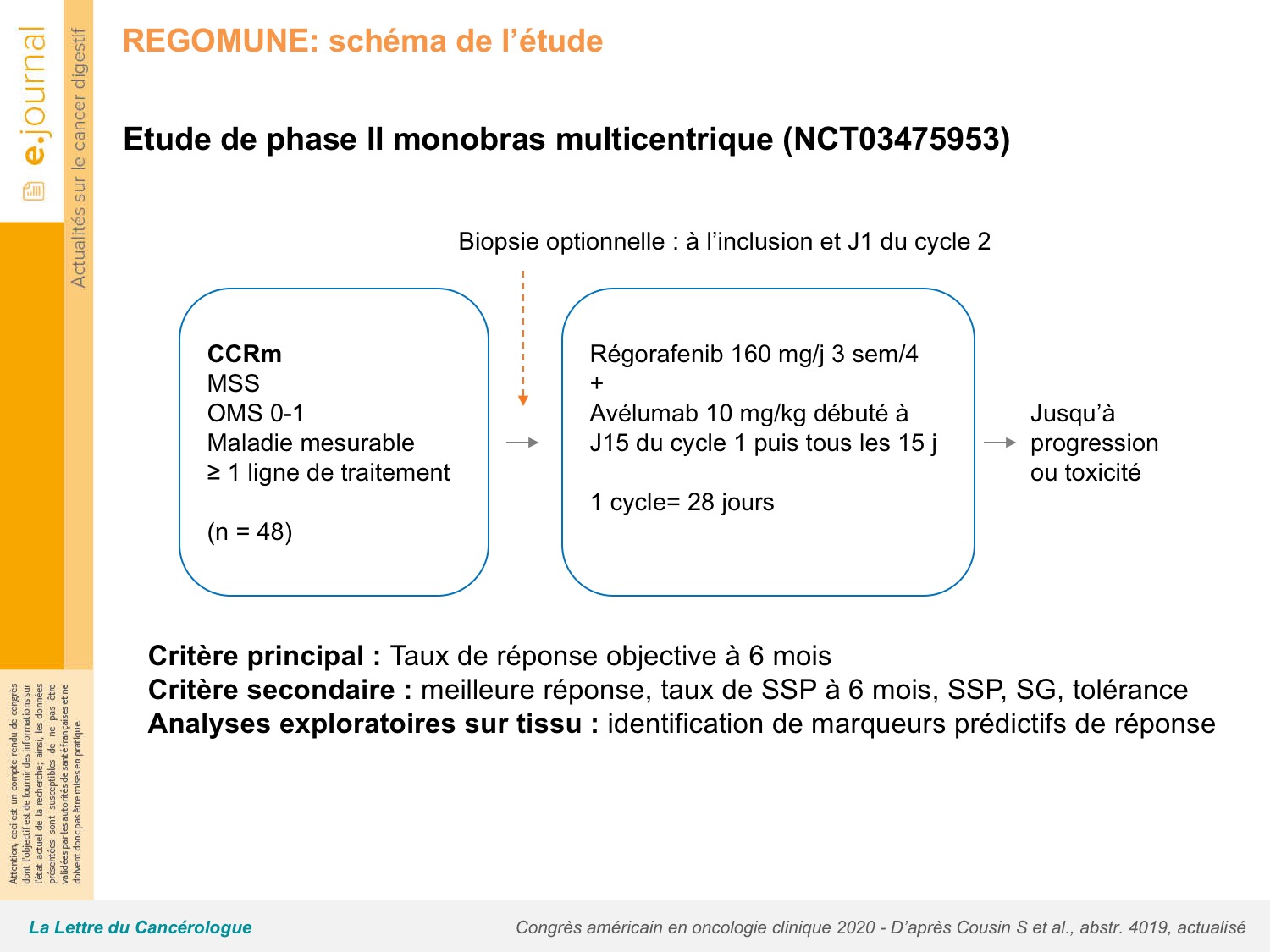
Sur les 48 patients inclus, 60 % étaient OMS 0, 64 % étaient RAS mutés, 6 % BRAF mutés, 87% avaient reçu ≥ 2 lignes de traitement dont 60 % avec une association anti-VEGF, 7 % avec un anti-EGFR et 35 % avaient reçu les 2 types de thérapie ciblée. Aucun patient n’avait été prétraité par régorafénib. Le taux de RO était nul, mais 28 % des patients avaient une réduction tumorale RECIST (43 patients évaluables) et le taux de contrôle de la maladie était de 53,5 % (figure 2). Après un suivi médian de 7,2 mois, la survie sans progression (SSP) était de 3,6 mois (1,8-5,4) et la SG de 10,8 mois (5,9-non atteinte). Les principales toxicités de grade 3-4 observées étaient le syndrome main-pied (30 %), l’hypertension artérielle (23 %), la diarrhée (13 %), le rash (9 %) et les anomalies biologiques hépatiques (13 %). L’analyse des biomarqueurs a mis en évidence une amélioration de la SSP (p = 0,037) et de la SG (p = 0,02) chez les patients avec une faible infiltration macrophagique tumorale et une faible distance entre les cellules tumorales et les lymphocytes T CD8+, mais seulement 6 (25 %) des 24 patients qui avaient accepté une nouvelle biopsie à l’inclusion étaient concernés.
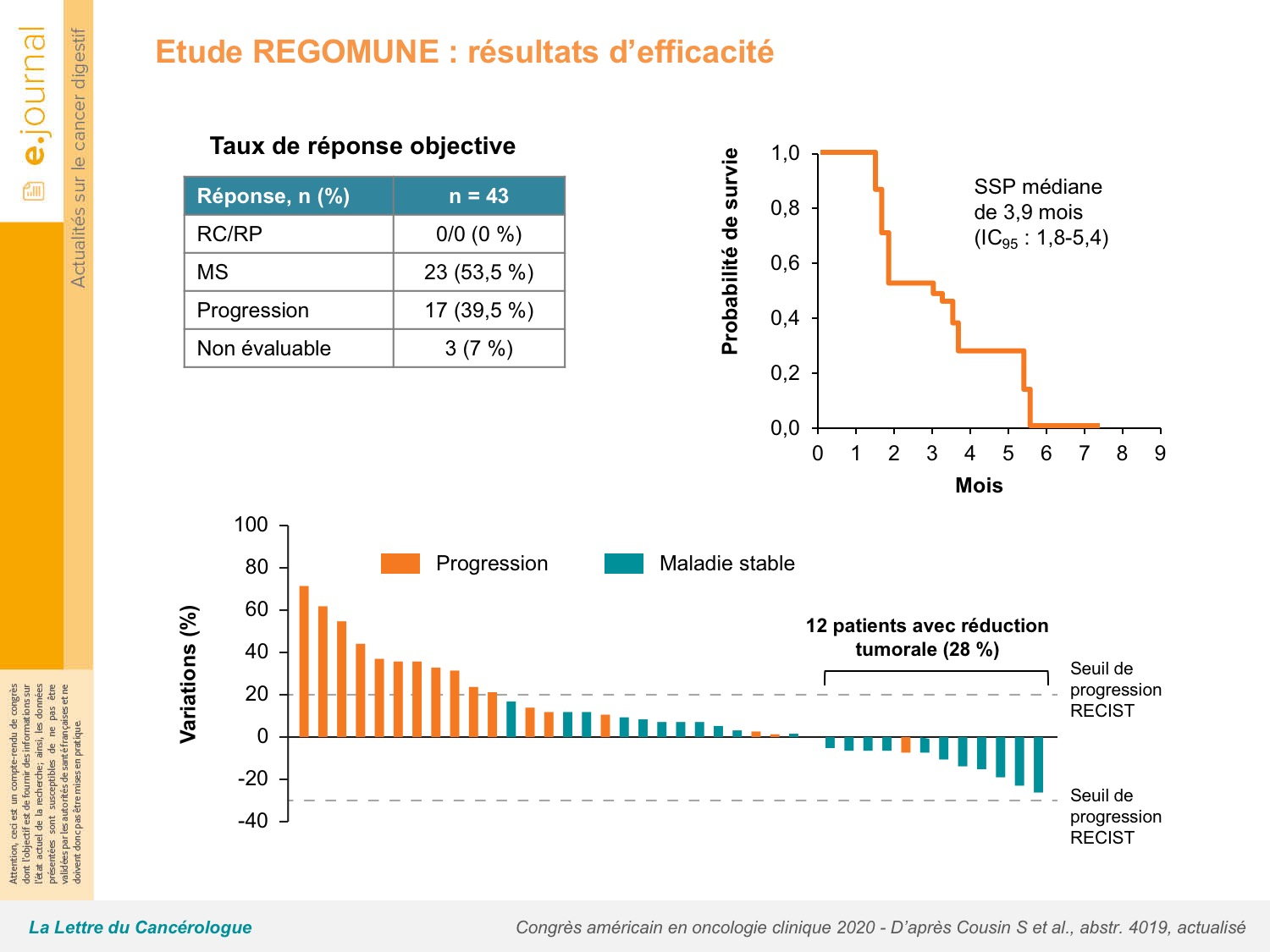
Au total, l’activité antitumorale de l’association régorafénib + avélumab n’est pas claire dans cette population de patients CCRm MSS lourdement prétraités et des biomarqueurs sont nécessaires pour identifier les patients qui bénéficieront d’une association régorafénib + anti-PD-(L)1. Y a-t-il également un effet de la dose de régorafénib (80 mg/j, 3 semaines/4 seulement dans la phase 1 REGONIVO) ou de l’anti-PD-(L)1 qui lui est associé ? L’étude de phase III REGONIVO comparant régorafénib + nivolumab à régorafénib seul devrait nous éclairer.

















